题目内容
设NA为阿伏加德罗常数,下列说法不正确的是( )
| A、标准状况下22.4L Cl2和H2混合气体原子数为2NA |
| B、1mol Na2O2和足量的水完全反应,转移的电子数为NA |
| C、1mol金刚石中含共价键数目为4NA |
| D、电解食盐水若产生2g氢气,则转移的电子数目为2NA |
考点:阿伏加德罗常数
专题:
分析:A、依据n=
计算物质的量,结合Cl2和H2混合气体都是双原子分子计算分析;
B、依据过氧化钠和水反应生成氢氧化钠和氧气,结合元素化合价变化计算电子转移;
C、依据金刚石结构分析,1mol碳原子形成2molC-C键计算分析判断;
D、依据电解饱和食盐水电解反应和电子守恒计算分析;
| V |
| 22.4 |
B、依据过氧化钠和水反应生成氢氧化钠和氧气,结合元素化合价变化计算电子转移;
C、依据金刚石结构分析,1mol碳原子形成2molC-C键计算分析判断;
D、依据电解饱和食盐水电解反应和电子守恒计算分析;
解答:
解:A、依据n=
计算物质的量=
=1mol,结合Cl2和H2混合气体都是双原子分子,含有原子数为2NA,故A正确
B、依据过氧化钠和水反应生成氢氧化钠和氧气,氧元素化合价变化从-1价变化为0价和-2价,1mol Na2O2和足量的水完全反应,转移的电子数为NA,故B正确;
C、依据金刚石结构分析,1mol碳原子形成2molC-C键,1mol金刚石中含共价键数目为2NA,故C错误;
D、电解食盐水若产生2g氢气,电解反应为2H++2e-=H2↑,则转移的电子数目为2NA,故D正确;
故选C.
| V |
| 22.4 |
| 22.4L |
| 22.4L/mol |
B、依据过氧化钠和水反应生成氢氧化钠和氧气,氧元素化合价变化从-1价变化为0价和-2价,1mol Na2O2和足量的水完全反应,转移的电子数为NA,故B正确;
C、依据金刚石结构分析,1mol碳原子形成2molC-C键,1mol金刚石中含共价键数目为2NA,故C错误;
D、电解食盐水若产生2g氢气,电解反应为2H++2e-=H2↑,则转移的电子数目为2NA,故D正确;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件应用,氧化还原反应电子转移计算,注意金刚石结构的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A、1mol Na+离子含有的核外电子数为NA |
| B、1mol Cl2与足量的铁反应,转移的电子数为3NA |
| C、标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
| D、常温下,10L pH=13的NaOH溶液中含有的OH-离子数为NA |
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3 +3F2=NF3 +3NH4F,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF.下列说法正确的是( )
| A、制取NF3的反应中,氧化剂与还原剂的物质的量之比为1:3 |
| B、NF3在潮湿的空气中泄漏会产生红棕色气体 |
| C、若在制取NF3的反应中有2molNH3参加反应,转移电子的物质的量为12mol |
| D、它在潮湿的环境中NF3是氧化剂,H2O是还原剂 |
下列关于氯水的叙述正确的是( )
| A、新制氯水呈黄绿色 |
| B、新制的氯水中只含Cl2和H2O分子 |
| C、新制氯水需置于无色试剂瓶中保存 |
| D、光照氯水有气泡逸出,该气体是Cl2 |
已知4g石墨完全转化成金刚石时需要吸收E kJ的能量.则下列表达正确的是( )
| A、石墨不如金刚石稳定 |
| B、C(石墨,s)═C(金刚石,s)△H=-3E kJ/mol |
| C、金刚石常温下可转化为石墨 |
| D、等质量的石墨和金刚石完全燃烧,金刚石放出的能量多 |
下列说法正确的( )
| A、PVC塑料指的是聚乙烯 |
| B、普通钢是纯净物,不锈钢是混合物 |
| C、实验室常用的蒸发皿属于硅酸盐产品 |
| D、光导纤维是以石油为原料生成的合成材料 |
氧化还原反应的实质是( )
| A、分子中的原子重新组合 |
| B、氧元素的得失 |
| C、电子的转移 |
| D、化合价的改变 |
NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,44 g C3H8中含有的碳碳单键数为3NA |
| B、1mol羟基中电子数为10NA |
| C、室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| D、标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
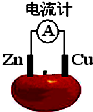 理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.