题目内容
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
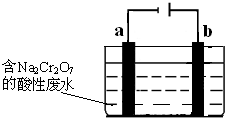
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.图1表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图.
①写出该反应的热化学方程式: .
②能判断该反应达到化学平衡状态的依据是 .
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.该构想技术流程如图2:
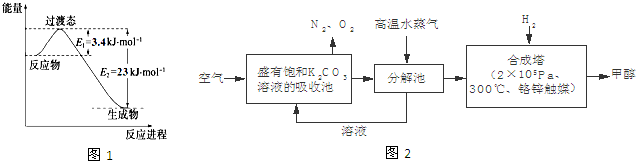
①向分解池中通入高温水蒸气的作用是 .
②甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式 .当电子转移的物质的量为 时,参加反应的氧气的体积是6.72L(标准状况下).
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题.该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如图3所示:
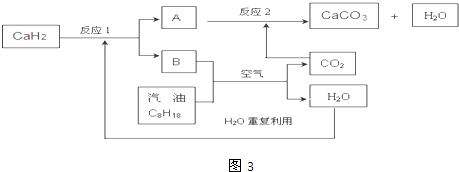
解决如下问题:①写出CaH2的电子式 .
②反应1中氧化剂与还原剂的物质的量之比是: .
③如该系统反应均进行完全,试写出该系统总反应的化学方程式 .
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气.图1表示恒压容器中0.5mol CO2和1.5mol H2转化率达80%时的能量变化示意图.
①写出该反应的热化学方程式:
②能判断该反应达到化学平衡状态的依据是
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.该构想技术流程如图2:

①向分解池中通入高温水蒸气的作用是
②甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题.该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如图3所示:

解决如下问题:①写出CaH2的电子式
②反应1中氧化剂与还原剂的物质的量之比是:
③如该系统反应均进行完全,试写出该系统总反应的化学方程式
考点:化学平衡状态的判断,氧化还原反应,原电池和电解池的工作原理
专题:
分析:(1)①根据图1可知0.5mol CO2和1.5mol H2转化率达80%时放热23-3.4=19.6KJ,然后按比例计算:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的△H得出该反应的热化学方程式;
②化学平衡的标志是正逆反应速率相同,各组分浓度保持不变,注意恒压条件;
(2)①空气在二氧化碳再吸收池中转化为碳酸氢钾,合成塔内为氢气与二氧化碳反应合成甲醇,所以分解池应提供二氧化碳;
②酸性条件下,负极上甲醇失电子发生氧化反应,正极上氧气得电子发生还原反应,根据转移电子和氧气之间的关系式计算;
(3)①CaH2为离子化合物,其电子式为 ;
;
②根据反应1(CaH2+2H2O=Ca(OH)2+2H2↑)中元素的化合价判断还原剂和氧化剂,再求物质的量之比;
③如该系统反应均进行完全,根据图3可知反应物CaH2、C8H18、O2和生成物CaCO3、H2O,根据守恒写出该系统总反应的化学方程式.
②化学平衡的标志是正逆反应速率相同,各组分浓度保持不变,注意恒压条件;
(2)①空气在二氧化碳再吸收池中转化为碳酸氢钾,合成塔内为氢气与二氧化碳反应合成甲醇,所以分解池应提供二氧化碳;
②酸性条件下,负极上甲醇失电子发生氧化反应,正极上氧气得电子发生还原反应,根据转移电子和氧气之间的关系式计算;
(3)①CaH2为离子化合物,其电子式为
 ;
;②根据反应1(CaH2+2H2O=Ca(OH)2+2H2↑)中元素的化合价判断还原剂和氧化剂,再求物质的量之比;
③如该系统反应均进行完全,根据图3可知反应物CaH2、C8H18、O2和生成物CaCO3、H2O,根据守恒写出该系统总反应的化学方程式.
解答:
解:(1)①根据图1可知0.5mol CO2和1.5mol H2转化率达80%时放热23-3.4=19.6KJ,则该反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-
×2=-49kJ?mol-1,故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49 kJ?mol-1;
②a.在恒压容器中压强始终不变,不能证明达到了平衡状态,故a错误;
b.混合气体中 H2的体积分数不变,说明各组分的体积分数都不变,正逆反应速率,达到了平衡状态,故b正确;
c.c(H2)=3c(CH3OH)不能说明达到平衡状态,故c错误;
d.反应两边都是气体,气体总质量不变,恒压条件该容器的容积改变,故气体的密度是变量,当气体的密度不变时,说明达到了平衡状态,故d正确;
e.2个C=O断裂的同时有6个H-H断裂,是同一方向的变化,在任意状态下均成立,不能说明达到平衡状态,故e错误;
故答案为:bd;
(2)①空气在二氧化碳再吸收池中转化为碳酸氢钾,合成塔内为氢气与二氧化碳反应合成甲醇,所以分解池应提供二氧化碳.向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解,故答案为:提供高温环境使KHCO3分解;
②负极上甲醇失电子发生氧化反应,电极反应式为CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应生成水,电极反应式为O2+4H++4e-=2H2O,根据氧气和转移电子之间的关系式得转移电子的物质的量=
×4=1.2mol,故答案为:CH3OH-6e-+H2O=CO2+6H+;1.2mol;
(3)①CaH2为离子化合物,其电子式为 故答案为:
故答案为: ;
;
②因反应1为:CaH2+2H2O=Ca(OH)2+2H2↑,CaH2中H元素的化合价由-1价变为0价是还原剂,H2O中H元素的化合价为+1价变为0价是氧化剂,氧化剂与还原剂的物质的量之比是2:1,故答案为:2:1;
③如该系统反应均进行完全,根据图3可知反应物CaH2、C8H18、O2和生成物CaCO3、H2O,根据守恒写出该系统总反应的化学方程式为:16CaH2+2C8H18+41O2=16CaCO3+34H2O.故答案为:16CaH2+2C8H18+41O2=16CaCO3+34H2O.
| 19.6mol |
| 80% |
②a.在恒压容器中压强始终不变,不能证明达到了平衡状态,故a错误;
b.混合气体中 H2的体积分数不变,说明各组分的体积分数都不变,正逆反应速率,达到了平衡状态,故b正确;
c.c(H2)=3c(CH3OH)不能说明达到平衡状态,故c错误;
d.反应两边都是气体,气体总质量不变,恒压条件该容器的容积改变,故气体的密度是变量,当气体的密度不变时,说明达到了平衡状态,故d正确;
e.2个C=O断裂的同时有6个H-H断裂,是同一方向的变化,在任意状态下均成立,不能说明达到平衡状态,故e错误;
故答案为:bd;
(2)①空气在二氧化碳再吸收池中转化为碳酸氢钾,合成塔内为氢气与二氧化碳反应合成甲醇,所以分解池应提供二氧化碳.向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解,故答案为:提供高温环境使KHCO3分解;
②负极上甲醇失电子发生氧化反应,电极反应式为CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应生成水,电极反应式为O2+4H++4e-=2H2O,根据氧气和转移电子之间的关系式得转移电子的物质的量=
| 6.72L |
| 22.4L/mol |
(3)①CaH2为离子化合物,其电子式为
 故答案为:
故答案为: ;
;②因反应1为:CaH2+2H2O=Ca(OH)2+2H2↑,CaH2中H元素的化合价由-1价变为0价是还原剂,H2O中H元素的化合价为+1价变为0价是氧化剂,氧化剂与还原剂的物质的量之比是2:1,故答案为:2:1;
③如该系统反应均进行完全,根据图3可知反应物CaH2、C8H18、O2和生成物CaCO3、H2O,根据守恒写出该系统总反应的化学方程式为:16CaH2+2C8H18+41O2=16CaCO3+34H2O.故答案为:16CaH2+2C8H18+41O2=16CaCO3+34H2O.
点评:本题考查较综合,涉及原电池原理、氧化还原反应、化学平衡判断等知识点,侧重考查基本理论,注意:化学平衡判断中只有“反应前后改变的物理量”才能作为判断依据,注意氢化钙电子式的书写方式,为易错点.

练习册系列答案
相关题目
月球的土壤中吸附着数百万吨的
He,每百吨
He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以
He的形式存在.下列说法不正确的是( )
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
对硅酸盐水泥的叙述不正确的是( )
| A、是黏土、石灰石、石膏的混合物 |
| B、水泥、沙子和水的混合物成为水泥沙浆 |
| C、水泥、沙子和碎石的混合物称为混凝土 |
| D、水泥和水混合搅拌后很容易凝固变硬具有水硬性 |
下列关于葡萄糖的说法中,错误的是( )
| A、葡萄糖的分子式是C6H12O6,是一种多羟基醛,因而具有醛和醇的性质 |
| B、葡萄糖是碳水化合物,因为它的分子(C6H12O6)是由6个碳原子和6个水分子组成的 |
| C、葡萄糖是提供给人体能量的营养物质,它在人体中主要发生氧化反应 |
| D、葡萄糖是单糖,它和果糖互为同分异构体 |
 如图表示1gO2与1gX气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
如图表示1gO2与1gX气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )| A、N2 |
| B、CH4 |
| C、CO2 |
| D、NO |