题目内容
8.在允许加热的条件下,只用一种试剂就可以鉴别(NH4)2SO4、KCl、Al2(SO4)3和Fe2(SO4)34种溶液,这种试剂是( )| A. | 氢氧化钠溶液 | B. | 氨水 | C. | 硝酸银溶液 | D. | 氯化钡溶液 |
分析 四种试剂阳离子不同,分别与NaOH的反应的现象为:刺激性气体、无现象、先生成白色沉淀后溶解、红褐色沉淀,以此来解答.
解答 解:A.(NH4)2SO4、KCl、Al2(SO4)3和Fe2(SO4)3分别与NaOH的反应的现象为:刺激性气体、无现象、先生成白色沉淀后溶解、红褐色沉淀,可鉴别,故A选;
B.(NH4)2SO4、KCl均与氨水不反应,不能鉴别,故B不选;
C.均与硝酸银反应生成白色沉淀,不能鉴别,故C不选;
D.(NH4)2SO4、Al2(SO4)3和Fe2(SO4)3均与氯化钡反应生成白色沉淀,不能鉴别,故D不选;
故选A.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应和现象等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
17.C6H14的各种同分异构体中,所含甲基数和它的一氯取代物的数目与下列叙述相符的是( )
| A. | 4个--CH3,能生成4种一氯代物 | B. | 3个--CH3,能生成4种一氯代物 | ||
| C. | 3个--CH3,能生成5种一氯代物 | D. | 2个--CH3,能生成4种一氯代物 |
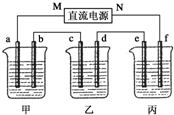 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.