题目内容
11.写出下列反应的化学方程式:(1)苯酚溶液和浓溴水的反应
 ;
;(2)1-溴丙烷和NaOH醇溶液共热BrCH2CH2CH3+NaOH$→_{△}^{醇}$CH3CH=CH2+NaBr+H2O;
(3)用苯制溴苯的反应
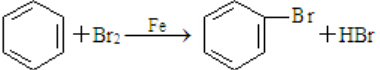 ;
;(4)乙醇的催化氧化2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O.
分析 (1)苯酚溶液和浓溴水的反应生成2,4,6-三溴苯酚和溴化氢;
(2)1-溴丙烷和NaOH醇溶液共热,发生消去反应生成丙烯、NaBr;
(3)苯和溴单质发生取代反应生成溴苯和HBr;
(4)乙醇被氧气催化氧化生成乙醛和水.
解答 解:(1)苯酚溶液和浓溴水的反应生成2,4,6-三溴苯酚和溴化氢,化学方程式: ,
,
故答案为: ;
;
(2)1-溴丙烷和NaOH醇溶液共热,发生消去反应生成丙烯、NaBr,该反应为BrCH2CH2CH3+NaOH$→_{△}^{醇}$CH3CH=CH2+NaBr+H2O,
故答案为:BrCH2CH2CH3+NaOH$→_{△}^{醇}$CH3CH=CH2+NaBr+H2O;
(3)苯和溴单质在铁作催化剂的条件下,发生取代反应生成溴苯和HBr,该反应为 ,
,
故答案为: ;
;
(4)乙醇在铜或银的作用下,发生催化氧化生成乙醛和水,该反应为2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O.
点评 本题主要考查了化学反应方程式的书写,明确有机物的结构特点及发生反应的原理是解题关键,题目难度不大,注意反应条件的书写.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
1.25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00mL浓度均为0.l000mol/L的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是( )
| 数据编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 由表中数据可估算出Ka(HX)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
2.六种短周期元素(a、b、c、d、e、f)的原子序数依次增大.其中a与e同主族,b与f同主族,e与f同周期;常温下a、e的单质状态不同;d的核电荷数是b的最外层电子数的2倍;单质f是一种重要的半导体材料.由此可推知( )
| A. | a、c两种元素只能组成化学式为ca3的化合物 | |
| B. | b、c、d分别与a形成的简单化合物,沸点由高到低依次为:d>c>b | |
| C. | 原子半径由大到小的顺序是 e>f>c>b>a | |
| D. | 元素的非金属性由强到弱的顺序是 d>c>f>b |
19.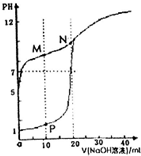 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )| A. | NaX溶液呈碱性 | B. | P点:c(Na+)>c(H+) | ||
| C. | M点:c(HX)+c(X-)=2c(Na+) | D. | M点水电离程度小于N点 |
6.14C常用于测定生物遗骸的年份.下列说法中正确的是( )
| A. | 14C的质量数为14g•mol-1 | B. | 14C与12C是两种不同的元素 | ||
| C. | 14C与C60互为同素异形体 | D. | 14C与14N中子数一定不同 |
16.下列各项表述正确的是( )
| A. | 水分子的结构式是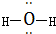 | |
| B. | NaCl的电子式为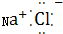 | |
| C. | 23Na37Cl中质子数和中子数之比是7:8 | |
| D. | 三氟化氮的电子式为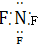 |
3.W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、4、8、8,它们的最外层电子数之和为18.下列说法错误的是( )
| A. | 阴离子的还原性:W>Z | B. | 单质的沸点:W>Y | ||
| C. | 最高价氧化物的水化物的酸性:Y<Z | D. | 四种元素一定都是非金属元素 |
1.下列用来表示物质变化的化学用语中,错误的是( )
| A. | 钢铁腐蚀时可能发生的正极反应为:2H2O+O2+4e-=4OH- | |
| B. | 向沸水中滴入几滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | 1L0.5mol•L-1稀硫酸与1L1mol•L-1氢氧化钠溶液反应放出57.3kJ的热量: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6kJ•mol-1 | |
| D. | 向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O |
 Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.
Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.