题目内容
1.为了检验FeCl2溶液是否变质,可向溶液中加入( )| A. | 盐酸 | B. | 铁片 | C. | KSCN溶液 | D. | 石蕊溶液 |
分析 检验某FeCl2溶液是否变质,可以通过检验溶液中是否存在Fe3+,检验方法是向溶液中加入KSCN溶液,观察现象,若溶液变红色,说明溶液中存在Fe3+,证明氯化亚铁变质,否则证明没有变质.
解答 解:A.加入盐酸,没有明显现象,无法检验是否变质,故A错误;
B.如果氯化亚铁变质,则生成氯化铁,少量氯化铁和铁片反应但现象不明显,铁片与氯化亚铁不反应,故B错误;
C.如果FeCl2溶液变质,变质后的物质是FeCl3,Fe3+能和SCN-生成络合物,使溶液呈现血红色现象明显,这一反应是Fe3+的特征反应,所以用KSCN溶液,故C正确;
D.无论氯化亚铁是否变质,都是强酸弱碱盐,溶液都呈酸性,所以无法检验,故D错误.
故选:C
点评 本题考查铁离子、亚铁离子的检验,为高频考点,侧重于学生的分析、实验能力的考查,注意检验Fe3+的物质有:KSCN(溶液变血红色)、苯酚(溶液呈紫色),难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
11.关于CF2Cl2 (商品名为氟里昂-12)的叙述正确的是( )
| A. | 属于卤代烃 | B. | 有两种同分异构体 | ||
| C. | 所有原子在同一平面上 | D. | 能发生消去反应 |
9.下列各组物质中,按熔点由低到高排列正确的是( )
| A. | O2、I2、Hg | B. | CO2、KCl、SiO2 | C. | Na、K、Rb | D. | SiC、NaCl、SO2 |
16.下列叙述中,正确的是( )
| A. | 氧化还原反应的特征是元素化合价发生了改变 | |
| B. | 含化合价升高元素的反应物被还原 | |
| C. | 得到电子的物质被氧化 | |
| D. | 氧化还原反应中,氧化剂和还原剂一定是两种物质 |
10.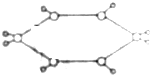 已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )
已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )
 已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )
已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )| A. | 属于芳香烃 | B. | 常温常压下为气体 | ||
| C. | 该烃的一氯代物有四种 | D. | 能使溴的四氯化碳溶液褪色 |
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | lmol的Na2CO3溶于盐酸形成混合溶液1L,常温下在pH=4时,c(CO32-)+c(HCO3-)+c(H2CO3)=0.lmol/L | |
| B. | 标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA | |
| C. | 等物质的量的O2和CO2所含氧原子数均为2NA | |
| D. | 6.8 g熔融的KHSO4中含有0.1 NA个阳离子 |
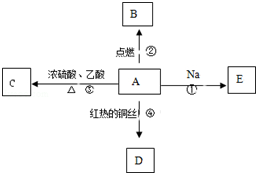 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应. .
. .
.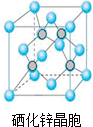 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.