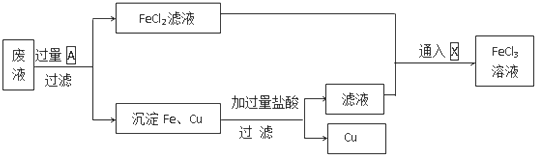
题目内容
20.有一瓶澄清的溶液,其中可能含有K+,Mg2+,Na+,Ba2+,Fe3+,Cl-,CO32-,SO42-等离子,取该溶液进行以下实验(1)用PH试纸检验,表明溶液呈强酸性,排除CO32-离子存在
(2)取部分溶液逐渐滴加入NaOH溶液,使溶液从酸性逐渐变成碱性,整个滴加过程中,溶液均无沉淀生成,则可排除Fe3+、Mg2+离子的存在.
(3)取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成,证明有Ba2+离子存在,又排除SO42-离子的存在.
(4)根据以上实验事实确定:该溶液中肯定存在的离子是Ba2+、Cl-.
分析 (1)溶液呈强酸性,说明溶液中含有大量的H+离子,与H+离子反应的离子不能大量共存;
(2)加入过量的氢氧化钠溶液,溶液中均无沉淀产生,说明溶液中无与OH-结合生成沉淀的离子;
(3)加碳酸钠溶液,有白色沉淀生成,该沉淀为碳酸盐沉淀;
(4)根据以上实验事实和溶液中电荷守恒确定确定原溶液中肯定存在的离子.
解答 解:(1)溶液呈强酸性,说明溶液中含有大量的H+离子,与H+离子反应的CO32-离子不能存在,
故答案为:CO32-;
(2)加入过量的氢氧化钠溶液,溶液中均无沉淀产生,说明溶液中无Fe3+、Mg2+离子,
故答案为:Fe3+、Mg2+;
(3)加碳酸钠溶液,有白色沉淀生成,该沉淀为BaCO3沉淀,证明Ba2+离子存在,一定不存在SO42-,
故答案为:Ba2+;SO42-;
(4)依据分析可知一定存在的离子有Ba2+离子,溶液中只剩氯离子,所以溶液中一定含Cl-离子;K+、Na+不能确定;Mg2+、Fe3+、CO32-、SO42-一定不存在,
故答案为:Ba2+、Cl-.
点评 本题考查离子共存问题,离子性质的分析判断,题目难度不大,注意溶液中电荷守恒的应用.

练习册系列答案
相关题目
5.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 100mL 8mol/LFeCl3溶液完全反应可制得0.8NA 个Fe(OH)3胶粒 | |
| B. | 0.1 mol 16OD-离子含有的电子、中子数均为1.0NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
12.下列说法正确的是( )
| A. | 1mol H2约为22.4L | |
| B. | 22.4LH2中含有6.02×1023是个氢分子 | |
| C. | 2g H2体积约为22.4L | |
| D. | 2g H2中含有6.02×1023个氢分子 |