题目内容
14.短周期元素A和B可形成AB3型化合物.若B原子序数为m,则下面表示A的原子序数的正确的算式个数为( )①m+6 ②m+4 ③m-4 ④m-2 ⑤m+8 ⑥m+14 ⑦m-12.
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
分析 根据短周期元素A和B组成的化合物的化学式为AB3,可知A的化合价可能为+3价、+6价或-3价,B的化合价可能为-1价、+1价或-2价,A可能属于ⅢA族、ⅥA族、ⅤA族元素,B可能属于ⅠA族、ⅥA族、VIIA族元素.则 A可能为 B、Al、S、N或 P元素,原子序数分别为5、13、16、7、15,B可能为F、Cl、O、S或 H元素,原子序数分别为 9、17、8、16、1,可能的化合物有 BF3、BCl3、AlF3、AlCl3、SO3、PH3、NH3、NF3、PCl3等.
解答 解:根据短周期元素A和B组成的化合物的化学式为AB3,可知A的化合价可能为+3价、+6价或-3价,B的化合价可能为-1价、+1价或-2价,A可能属于ⅢA族、ⅥA族、ⅤA族元素,B可能属于ⅠA族、ⅥA族、VIIA族元素.则 A可能为 B、Al、S、N或 P元素,原子序数分别为5、13、16、7、15,B可能为F、Cl、O、S或 H元素,原子序数分别为 9、17、8、16、1,可能的化合物有 BF3、BCl3、AlF3、AlCl3、SO3、PH3、NH3、NF3、PCl3等;根据这几种元素的原子序数可知,当 B的原子序数为 m时,A的原子序数可能是:m-4、m-12、m+4、m-4、m+14,、m+8、m+6、m-2、3即这七种情况都存在,
故选 D.
点评 本题考查原子结构和元素性质,为高频考点,明确原子结构、元素周期表结构、原子序数之间的关系是解本题关键,侧重考查学生思维缜密性、发散思维能力等,题目难度中等.

练习册系列答案
相关题目
4.下列说法中正确的是( )
| A. | 因为p轨道是“8”字形的,所以p的电子走“8”字形 | |
| B. | K能级有3s,3p,3d,3f四个轨道 | |
| C. | 碳原子的2p轨道上有两个自旋相反的电子 | |
| D. | 以上说法均不正确 |
5.表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
(1)第3周期中金属性最强的元素是钠(填元素名称);
(2)S原子结构示意图为 ;
;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第3周期中气态氢化物最稳定的是HCl;
(6)Si是带来人类文明的重要元素之一,其氧化物化学式是SiO2;
(7)铝是大自然赐予人类的宝物.它的一个用途是发生铝热反应,冶炼某些难熔金属,写出该反应的一个化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3
(8)N元素形成的氢化物是NH3,它和HCl相遇后的现象是有白烟产生.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
(2)S原子结构示意图为
 ;
;(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第3周期中气态氢化物最稳定的是HCl;
(6)Si是带来人类文明的重要元素之一,其氧化物化学式是SiO2;
(7)铝是大自然赐予人类的宝物.它的一个用途是发生铝热反应,冶炼某些难熔金属,写出该反应的一个化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3
(8)N元素形成的氢化物是NH3,它和HCl相遇后的现象是有白烟产生.
2.下列物质中的碳原子的轨道杂化属于sp的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 乙炔 |
9.蛋白质的元素组成比油脂多了下列哪种元素( )
| A. | 氢 | B. | 氮 | C. | 氧 | D. | 硅 |
19.有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素的原子序数之和为56,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:
(1)B元素在周期表中的位置为第三周期VA族;
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其化学式为H2O2;
(3)C的最高价氧化物的水化物与E单质的反应属于放热反应(填“吸热”或“放热”);生成物的总能量小于(填“大于”、“小于”或“等于”)反应物的总能量.
| A | ||||
| E | B | C | D |
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其化学式为H2O2;
(3)C的最高价氧化物的水化物与E单质的反应属于放热反应(填“吸热”或“放热”);生成物的总能量小于(填“大于”、“小于”或“等于”)反应物的总能量.
4.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向无色溶液中滴加氯水和CCl4,振荡静置 | 下层溶液显紫色 | 溶液中含有I- |
| B | 过量铁粉加入稀硝酸中充分反应,再加入 KSCN溶液 | 溶液呈红色 | 稀硝酸将铁氧化为Fe3+ |
| C | 向BaC12溶液中先通入SO2 | 生成白色沉淀 | 白色沉淀是BaSO4 |
| D | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸先变红后变黑 | 浓硫酸具有酸性和脱水性 |
| A. | A | B. | B | C. | C | D. | D |
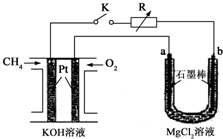 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.请回答下列问题:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.请回答下列问题: