题目内容
【题目】酚酞,别名非诺夫他林,是制药工业原料,其结构如图所示,有关酚酞说法不正确的是( ) 
A.分子式为C20H14O4
B.可以发生取代反应、加成反应、氧化反应
C.含有的官能团有羟基、酯基
D.1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol
【答案】D
【解析】解:A.由结构简式可知分子式为C20H14O4 , 故A正确;
B.含酚﹣OH可发生取代、氧化反应,含苯环可发生加成反应,故B正确;
C.分子中含酚﹣OH、﹣COOC﹣,即含有的官能团有羟基、酯基,故C正确;
D.只有苯环与氢气发生加成反应,酚﹣OH的邻对位与溴水发生取代,且对位均有取代基,则1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为9mol和4mol,故D错误.
故选D.
【考点精析】利用有机物的结构和性质对题目进行判断即可得到答案,需要熟知有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2 .
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:;
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是;
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显性,用化学平衡原理解释;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):;
a.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
c.c(Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下: 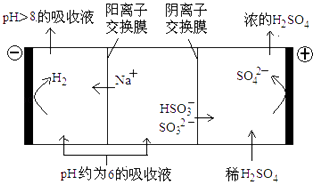
①HSO3﹣在阳极放电的电极反应式是;
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理 .