题目内容
7.对于可逆反应2AB3(g)?2A(g)+3B2(g)△H>0,下列图象不正确的是( )| A. | 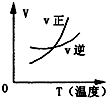 | B. | 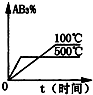 | C. | 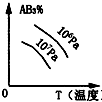 | D. |  |
分析 该反应吸热反应,升高温度,反应速率增大,平衡正向移动,AB3的含量减小;且该反应为气体体积增大的反应,增大压强,平衡逆向移动,AB3的含量增大,结合图象来解答.
解答 解:A.该反应吸热反应,升高温度,平衡正向移动,图中交叉点后正反应速率大于逆反应速率,故A正确;
B.温度高,反应速率快,且温度高平衡正向移动,AB3的含量减小,与图象一致,故B正确;
C.温度高平衡正向移动,AB3的含量减小,压强大时平衡逆向移动,AB3的含量增大,与图象不符,故C错误;
D.温度高平衡正向移动,AB3的含量减小,压强大时平衡逆向移动,AB3的含量增大,与图象一致,故D正确;
故选C.
点评 本题考查化学平衡的移动及图象,为高频考点,把握图象中纵横坐标及温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.

练习册系列答案
相关题目
2.下列原子中,第一电离能最大的是( )
| A. | He | B. | C | C. | Al | D. | Si |
12. A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:
A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:
(1)E原子的基态电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)A、B、C三种元素的第I电离能由大到小的顺序是N>O>Na,
(3)D能形成多种价态的含氧酸,其酸性由强到弱的顺序为HClO4>HClO3>HClO2>HClO.
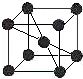
(4)已知金属C单质的晶胞为,则C原子的堆积方式为体心立方堆积,C原子的配位数是8,
(5)向E、D形成的稳定化合物溶液中不断加入A的常见氢化物水溶液,最后E的最主要存在形式为(写真实符号)Cu(NH3)42+.
 A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:
A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:| A | B | |
| D |
(2)A、B、C三种元素的第I电离能由大到小的顺序是N>O>Na,
(3)D能形成多种价态的含氧酸,其酸性由强到弱的顺序为HClO4>HClO3>HClO2>HClO.
(4)已知金属C单质的晶胞为,则C原子的堆积方式为体心立方堆积,C原子的配位数是8,
(5)向E、D形成的稳定化合物溶液中不断加入A的常见氢化物水溶液,最后E的最主要存在形式为(写真实符号)Cu(NH3)42+.
16.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)A元素在周期表中的位置是第二周期第VA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题
有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=3NaOH+NH3•H2O.
(4)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol

(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题
有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=3NaOH+NH3•H2O.
(4)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol

(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
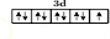 ;
;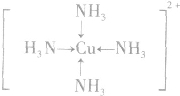 ;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;
;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;
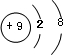 ,该元素与金属性最强的元素形成的化合物的电子式为
,该元素与金属性最强的元素形成的化合物的电子式为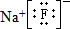 ;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).
;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).