题目内容
对于一定温度下的密闭容器中,可逆反应H2(g)+I2(g)![]() 2HI(g)达到平衡的标志是( )
2HI(g)达到平衡的标志是( )
A.压强不随时间的变化而变化 B.混合气的平均相对分子质量一定
C.生成n mol H2的同时生成2n mol HI D.v(H2)=v(I2)
C
解析:
平衡状态的本质是正、逆反应速率相等。由于反应前后气体的体积不变,所以不管是否平衡,混合气的平均相对分子质量不变,压强也不随时间的变化而变化。而H2(g)和I2(g)的化学计量数相同,反应速率始终相等。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
在一定温度下的定容密闭容器中,对于反应A(s)+2B(g)?C(g)+D(g),当下列物理量不再改变时,表明反应已达平衡的是( )
| A、混合气体的压强 | B、混合气体的密度 | C、混合气体的总体积 | D、气体总物质的量 |
近年来,我国部分地区多次陷入严重雾霾之中,其中一个重要的原因是我国的能源消费结构以燃煤为主,改变煤的利用方式可减少环境污染.以下是对煤进行处理的方法:
(1)将水蒸气通过红热的碳即可产生水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,
①该反应在 下能自发进行(填“高温”或“低温”);
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为 .(已知:H2S Ka1=9.1×10-8;Ka2=1.1×10-12 H2CO3 Ka1=4.30×10-7;Ka2=5.61×10-11)
(2)利用水煤气作为合成气,在同一个容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚,此工艺称之为“一步法”合成二甲醚.
①一步法合成二甲醚:3H2(g)+3CO(g)=CH3OCH3(g)+CO2 (g)△H= .
②该反应在一定条件下的密闭容器中达到平衡后,为同时提高化学反应速率和二甲醚的产率,可以采取的措施是 (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
(3)控制反应条件,水煤气作为合成气也可以用来合成甲醇.在相同条件下合成二甲醚和合成甲醇的原料转化率随氢碳比的变化如图所示:
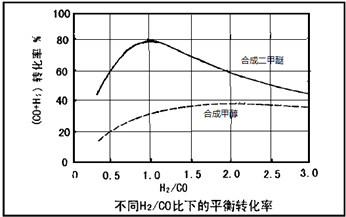
①合成二甲醚的最佳H2/CO比为 .对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),写出“一步法”合成二甲醚的KP= ,提高H2/CO比,则KP (填“变大”、“变小”或“不变”)
②以水煤气作为原料气,在相同条件下一步法合成二甲醚的转化率为什么明显高于合成甲醇的转化率 .
(1)将水蒸气通过红热的碳即可产生水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,
①该反应在
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(2)利用水煤气作为合成气,在同一个容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚,此工艺称之为“一步法”合成二甲醚.
| 反应过程 | 化学方程式 | △H(kJ?mol-1) |
| 甲醇合成反应 | 2H2(g)+CO(g)=CH3OH(g) | -90.8 |
| 水煤气变换反应 | CO(g)+H2O(g)═CO2(g)+H2(g) | -41.3 |
| 甲醇脱水反应 | 2CH3OH(g)=CH3OCH3(g)+H2O(g) | -23.5 |
②该反应在一定条件下的密闭容器中达到平衡后,为同时提高化学反应速率和二甲醚的产率,可以采取的措施是
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
(3)控制反应条件,水煤气作为合成气也可以用来合成甲醇.在相同条件下合成二甲醚和合成甲醇的原料转化率随氢碳比的变化如图所示:

①合成二甲醚的最佳H2/CO比为
②以水煤气作为原料气,在相同条件下一步法合成二甲醚的转化率为什么明显高于合成甲醇的转化率
 H= −241.8kJ/mol
H= −241.8kJ/mol  2SO3(g);
2SO3(g); 2NO(g)
2NO(g)