题目内容
根据物质结构与元素周期律及周期表的知识,回答下列问题:
(1)第三周期元素中,最活泼的非金属元素的最高价氧化物的水化物的化学式是
(2)某元素位于第三周期ⅣA族,该元素的元素符号是 .
(3)某元素A与氟元素能形成离子化合物AF2,其中阴、阳离子的电子层结构相同.则A的元素符号是
(4)钾元素与铝元素位于不同周期和不同主族,但可以通过另一种元素作参照,比较出钾与铝的金属性强弱,这种参照元素是 .
(1)第三周期元素中,最活泼的非金属元素的最高价氧化物的水化物的化学式是
(2)某元素位于第三周期ⅣA族,该元素的元素符号是
(3)某元素A与氟元素能形成离子化合物AF2,其中阴、阳离子的电子层结构相同.则A的元素符号是
(4)钾元素与铝元素位于不同周期和不同主族,但可以通过另一种元素作参照,比较出钾与铝的金属性强弱,这种参照元素是
考点:元素周期表的结构及其应用,元素周期律的作用,原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:(1)同周期元素的原子从左到右非金属的活泼性逐渐增强,对应的元素最高价氧化物的水化物的酸性逐渐增强,稀有气体元素除外;
(2)根据周期数等于电子层数,族序数等于最外层电子数解答;
(3)和氟离子电子层结构相同且为正二价的是镁元素;
(4)根据金属钾和金属镁在周期表中的位置关系来回答.
(2)根据周期数等于电子层数,族序数等于最外层电子数解答;
(3)和氟离子电子层结构相同且为正二价的是镁元素;
(4)根据金属钾和金属镁在周期表中的位置关系来回答.
解答:
解:(1)同周期自左而右,非金属性增强,故第三周期元素中,非金属性Cl>S>P>Si,非金属性越强,化学性质越活泼,对应的元素最高价氧化物的水化物的酸性就越强,故Cl元素最活泼,其最高价氧化物对应的水化物为HClO4,
故答案为:HClO4;
(2)某元素位于第三周期说明该元素含有三层电子,ⅣA族说明最外层电子数为4,则该元素质子数为14,为硅元素,符号为:Si,
故答案为:Si;
(3)根据离子化合物AF2的化学式可以确定A显正二价,和氟离子电子层结构相同且为正二价的是镁元素,
故答案为:Mg;
(4)金属钾的上方是金属Na,Na和金属镁在周期表中位于同周期相邻的位置,所以比较出钾与镁的金属性强弱,可以选择Na为参照元素,
故答案为:Na.
故答案为:HClO4;
(2)某元素位于第三周期说明该元素含有三层电子,ⅣA族说明最外层电子数为4,则该元素质子数为14,为硅元素,符号为:Si,
故答案为:Si;
(3)根据离子化合物AF2的化学式可以确定A显正二价,和氟离子电子层结构相同且为正二价的是镁元素,
故答案为:Mg;
(4)金属钾的上方是金属Na,Na和金属镁在周期表中位于同周期相邻的位置,所以比较出钾与镁的金属性强弱,可以选择Na为参照元素,
故答案为:Na.
点评:本题考查元素周期表的结构和元素周期律的有关知识,可以根据所学知识进行回答,要求学生具有分析和解决问题的能力,题目难度中等.比较出钾与铝的金属性强弱参照元素的选择是该题的难点.

练习册系列答案
相关题目
分类法是学习和研究化学的一种重要方法.下列分类不合理的是( )
| A、KOH和Na2CO3都属于碱 |
| B、K2CO3和KHCO3都属于盐 |
| C、H2SO4和HNO3都属于酸 |
| D、Na2O和SiO2都属于氧化物 |
能正确表示下列反应的离子方程式的是( )
| A、氢氧化钡溶液与硫酸反应:H++OH-=H2O |
| B、铁溶于氯化铁溶液:Fe3++Fe=2Fe2+ |
| C、氢氧化钠溶液与硫酸铜溶液反应:2OH-+Cu2+=Cu(OH)2↓ |
| D、碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
根据下列变化,判断属于还原反应的是( )
| A、HCl→Cl2 |
| B、S→SO2 |
| C、Fe(OH)3→Fe2O3 |
| D、CuO→Cu |
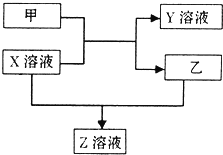 甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答:
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答: