题目内容
19.NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 在某密闭容器中加入0.5molN2和1.5molH2,充分反应后容器中物质含有的N-H键数为3NA | |
| B. | 标准状况下,2.24LSO3含有的原子数为0.4 NA | |
| C. | 71g氯气与足量铁反应过程中转移的电子数为2NA | |
| D. | 电解饱和食盐水时,当阴极产生22.4LH2时,电路中转移的电子数为2NA |
分析 A.氮气与氢气反应为可逆反应,依据可逆反应不能进行到底解答;
B.气体摩尔体积使用对象为气体;
C.氯气与铁反应生成氯化铁,氯气不足,依据氯气的量计算转移电子数;
D.气体状况未知,产生氢气的物质的量无法计算.
解答 解:A.A、氮气与氢气合成氨的反应是可逆反应,所以在密闭容器中加入0.5moLN2和1.5moLH2,充分反应后容器中的N-H键数小于3NA,故A错误;
B.标准状况下SO3是非气态物质,无法求得其物质的量,故B错误;
C.71g氯气即1mol,与足量铁反应转移的电子数为2NA,故C正确;
D.电解饱和食盐水时,当阴极产生22.4LH2时,由于条件未指出,所以不能确定气体的物质的量和转移的电子数,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数,明确以物质的量为核心的计算公式是解题关键,解题时注意物质的状态、存在的条件、物质的性质和分子的组成等因素,题目难度不大.

练习册系列答案
相关题目
9.蛋白质是生命的基础物质,下列关于蛋白质的说法正确的是( )
| A. | 蛋白质的种类很多,它们都能溶解于水 | |
| B. | 蛋白质水解的最终产物是氨基酸 | |
| C. | 蛋白质溶液中加入浓盐酸,颜色变黄 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质将变性 |
10.已知2mol H2(g)燃烧生成液态水放出的热量为571.6lkJ,而2molH2 (g)完全燃烧生成气态水放的热量为483.6kJ.下列说法正确的是( )
| A. | l molH2O (I)变成lmolH2O (g),向外界释放能量 | |
| B. | 1molH2O (g)分解成H2(g)和O2(g),吸收241. 8kJ能量 | |
| C. | 2mol H2(g)和l mol O2(g)的总能量小于2molH2O(1)的能量 | |
| D. | 断裂2molH2O (g)中所有的O-H键,吸收483.6 kJ能量 |
7.(1)氯碱工业是利用电解食盐水生产烧碱、氯气为基础的工业体系.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
为生产七水硫酸镁,设计了以下工艺流程:
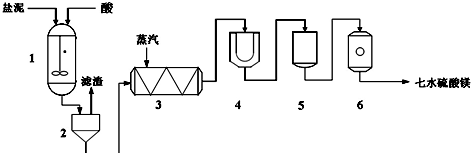
生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动.
装置2中滤渣的主要成分为CaSO4、BaSO4、其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动.
装置2中滤渣的主要成分为CaSO4、BaSO4、其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
11.用石墨电极电解NaCl和CuSO4的混合溶液,开始时和一段时间后阴极析出的物质依次是( )
| A. | H2和Cl2 | B. | Cu和 O2 | C. | H2和Na | D. | Cu 和 H2 |
9.已知:常温下浓度为0.1mol/L的下列溶液的pH如表:
下列有关说法正确的是( )
| 溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
| pH | 7.5 | 11.6 | 9.7 | 8.3 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L | |
| C. | 等体积等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后 | |
| D. | 向Na2CO3溶液中通入少量的HF气体,化学反应方程式为:Na2CO3+2HF═CO2+H2O+2NaF |
 .
.