题目内容
4.将一块镁铝合金溶于盐酸后,加入过量氢氧化钠溶液,过滤后灼烧沉淀物,所得白色粉末的质量等于原合金的质量,则该合金中镁铝的质量比是( )| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 2:1 |
分析 镁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化镁,则经洗涤、干燥、灼烧,得到白色粉末为氧化镁,氧化镁质量等于合金的质量,由组成可知氧化镁中氧元素的质量等于合金中铝的质量,以此来解答.
解答 解:由镁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化镁,则经洗涤、干燥、灼烧,得到白色粉末为MgO,MgOg质量等于Mg、Al合金的质量,由组成可知氧化镁中氧元素的质量等于合金中铝的质量,则合金中Mg、Al的质量比为24:16=3:2,
故选A.
点评 本题考查混合物的计算,为高频考点,把握白色粉末为MgO及物质的组成为解答的关键,侧重分析与计算能力的考查,注意Mg元素的质量守恒,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
14.下列关于胶体的叙述中正确的是( )
| A. | 胶体是一种液态混合物,属于分散系的一种 | |
| B. | 用丁达尔效应可区分Fe(OH)3胶体、水、CuSO4溶液 | |
| C. | 用过滤器可以将胶体和溶液分开 | |
| D. | 胶体的本质特征是发生丁达尔效应 |
15.实验室中从溴水中提取溴,应采用的操作方法是( )
| A. | 过滤 | B. | 蒸发 | C. | 蒸馏 | D. | 萃取 |
12.下列说法正确的是( )
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 与金属反应时,稀HNO3被还原为NO,而浓HNO3被还原为NO2,故稀硝酸的氧化性强于浓硝酸 | |
| D. | 用10 mL量筒量取9.2 mL NaCl溶液 |
19.在298K,1.01×105Pa下•将22gCO2通入750mllmol/LNaOH溶液中充分反应,测得放出xkJ的热量.己知在该条件下,1molCO2通入1L2mol/LNaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
| A. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(2y-x)kJ/mol | |
| B. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(2x-y)kJ/mol | |
| C. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(4x-y)kJ/mol | |
| D. | 2CO2 (g)+2NaOH (1)═2NaHCO3 (1)△H=-(8x-2y)kJ/mol |
9.下列化学用语使用正确的是( )
| A. | 乙酸的分子式:CH3COOH | B. | 甲烷的结构简式:CH4 | ||
| C. | 35Cl表示该氯原子核内有20个中子 | D. | SiO2是二氧化硅的分子式 |
16.中和一定量的某醋酸溶液时,消耗氢氧化钠m g,如果先向该醋酸溶液中加入少量的醋,然后再用氢氧化钠中和,此时可消耗氢氧化钠n g,则m与n的关系为( )
| A. | m>n | B. | m<n | C. | m=n | D. | 无法确定 |
13.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.
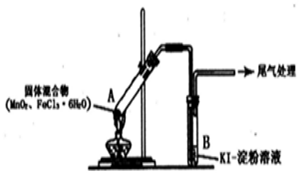
实验操作和现象如表:
回答下列问题:
(l)上述实验中的白雾是盐酸小液滴;试管A管口向上倾斜的原因是试管A中部分固体溶解在FeCl3•6H2O分解生成的水中形应溶液
(2)实验2说明黄色气体中含有FeCl3,写出FeCl3使KI一淀粉溶液变蓝的离子方程式:2Fe3++2I-=2Fe2++I2
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色.
方案2:将B中KI一淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+.则方案1C中盛放的试剂是饱和NaCl溶液;方案2中检验Fe2+的试剂是铁氰化钾溶液,选择NaBr溶液的依据是Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2.
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+MnCl2+Cl2↑+2HCl+11H2O;其尾气处理的方法是将尾气通入到氢氧化钾溶液中.
(5)该学习小组认为实验1 中溶液变蓝,可能还有另外一种原因是:实验未先赶出空气,其中的O2在此条件下可能氧化I-.请你设计实验方案验证此猜想:向一试管中加入KI-淀粉溶液.再滴入几滴稀盐酸,在空气中放置,观察一段时间后溶液是否变蓝.

实验操作和现象如表:
| 实验编号 | 操作 | 现象 |
| 实验1 | 按上图所示加热MnO2与FeCl3•6H2O 混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
| 实验2 | 把A中的混合物换为FeC13•6H2O,B中溶液换为KSCN溶液,加热. | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
(l)上述实验中的白雾是盐酸小液滴;试管A管口向上倾斜的原因是试管A中部分固体溶解在FeCl3•6H2O分解生成的水中形应溶液
(2)实验2说明黄色气体中含有FeCl3,写出FeCl3使KI一淀粉溶液变蓝的离子方程式:2Fe3++2I-=2Fe2++I2
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色.
方案2:将B中KI一淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+.则方案1C中盛放的试剂是饱和NaCl溶液;方案2中检验Fe2+的试剂是铁氰化钾溶液,选择NaBr溶液的依据是Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2.
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为MnO2+2FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+MnCl2+Cl2↑+2HCl+11H2O;其尾气处理的方法是将尾气通入到氢氧化钾溶液中.
(5)该学习小组认为实验1 中溶液变蓝,可能还有另外一种原因是:实验未先赶出空气,其中的O2在此条件下可能氧化I-.请你设计实验方案验证此猜想:向一试管中加入KI-淀粉溶液.再滴入几滴稀盐酸,在空气中放置,观察一段时间后溶液是否变蓝.
14.下列物质中,不能通过化合反应制取的是( )
| A. | FeCl2 | B. | H2SiO3 | C. | CaSiO3 | D. | Cu2(OH)2CO3 |