题目内容
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料做惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子.
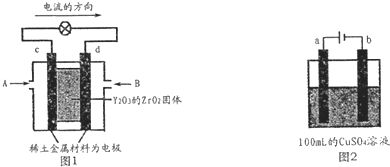
(1)c电极的名称为
(2)如图2所示电解100mL 0.5mol?L-1 CuSO4溶液,a电极上的电极反应式为
a. CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3.

(1)c电极的名称为
正极
正极
,d电极上的电极反应式为CH4+4O2-═CO2+2H2O+8e-
CH4+4O2-═CO2+2H2O+8e-
.(2)如图2所示电解100mL 0.5mol?L-1 CuSO4溶液,a电极上的电极反应式为
4OH-═2H2O+O2↑+4e-
4OH-═2H2O+O2↑+4e-
.若a电极产生56mL(标准状况)气体,则所得溶液的pH=1
1
(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入ac
ac
(填序号).a. CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3.
分析:(1)依据装置图中电流流向分析,c为正极,氧气的电子发生还原反应,d为负极,甲烷失电子发生氧化反应;
(2)图2是电解池,与电源正极连接的a电极为阳极,发生4OH--4e-═O2↑+2H2O,b为阴极,发生为Cu2++2e-═Cu,结合电极方程式计算.
(2)图2是电解池,与电源正极连接的a电极为阳极,发生4OH--4e-═O2↑+2H2O,b为阴极,发生为Cu2++2e-═Cu,结合电极方程式计算.
解答:解:(1)图1是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极,甲烷失电子发生还原反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子,负极电极反应为:CH4+4O2-═CO2+2H2O+8e-;
故答案为:正极; CH4+4O2-═CO2+2H2O+8e-;
(2)如图2所示电解100mL0.5mol?L-1CuSO4溶液,发生的电解池反应为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,溶液中 氢氧根离子失去电子发生氧化反应,电极反应为:4OH-═2H2O+O2↑+4e-;
若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=
=0.1mol/L,pH=-lg0.1=1;
则所得溶液电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使CuSO4溶液,恢复原浓度,应加入CuO,也可以加入CuCO3,符合恢复溶液浓度的定量关系,但不能加入Cu(OH)2、Cu2(OH)2CO3,因为CuCO3+H2SO4═CuSO4+CO2↑+H2O,相当于加CuO,而Cu(OH)2+H2SO4═CuSO4+2H2O、Cu2(OH)2CO3+2H2SO4═2CuSO4 +CO2↑+3H2O,除增加溶质外还增加了水;故选ac.
故答案为:4OH-═2H2O+O2↑+4e-;1;ac.
故答案为:正极; CH4+4O2-═CO2+2H2O+8e-;
(2)如图2所示电解100mL0.5mol?L-1CuSO4溶液,发生的电解池反应为:2CuSO4+2H2O
| ||
若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=
| 0.01mol |
| 0.1L |
则所得溶液电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使CuSO4溶液,恢复原浓度,应加入CuO,也可以加入CuCO3,符合恢复溶液浓度的定量关系,但不能加入Cu(OH)2、Cu2(OH)2CO3,因为CuCO3+H2SO4═CuSO4+CO2↑+H2O,相当于加CuO,而Cu(OH)2+H2SO4═CuSO4+2H2O、Cu2(OH)2CO3+2H2SO4═2CuSO4 +CO2↑+3H2O,除增加溶质外还增加了水;故选ac.
故答案为:4OH-═2H2O+O2↑+4e-;1;ac.
点评:本题考查电解的有关判断,是中等难度的试题,试题综合性强,在注重对基础知识巩固和训练的同时,主要是侧重对学生能力的培养,有助于培养学生的逻辑思维能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
