��Ŀ����
��--��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��SO2 +2H2O +I2 =H2SO4 +2HI
��2HI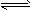 H2 +I2
H2 +I2
��2H2SO4 =2SO2 +O2 +2H2O
(1)����������Ӧ�������ж���ȷ����_______
a����Ӧ�����ڳ����½���
b����ӦI��SO2�����Ա�HIǿ
c��ѭ���������貹��H2O
d��ѭ�������в���1 mol O2��ͬʱ����1 mol H2
(2)һ���¶��£���1 L�ܱ������м���1mol HI(g)��������Ӧ��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
��SO2 +2H2O +I2 =H2SO4 +2HI
��2HI
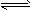 H2 +I2
H2 +I2��2H2SO4 =2SO2 +O2 +2H2O
(1)����������Ӧ�������ж���ȷ����_______
a����Ӧ�����ڳ����½���
b����ӦI��SO2�����Ա�HIǿ
c��ѭ���������貹��H2O
d��ѭ�������в���1 mol O2��ͬʱ����1 mol H2
(2)һ���¶��£���1 L�ܱ������м���1mol HI(g)��������Ӧ��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
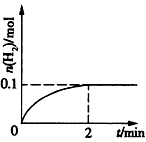
0~2 min�ڵ�ƽ����Ӧ����v(HI)=____�����¶��£�H2(g)+I2(g) 2HI(g)��ƽ�ⳣ��K=____ ��ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������____��ԭ����2����
2HI(g)��ƽ�ⳣ��K=____ ��ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������____��ԭ����2����
a��ƽ�ⳣ�� b��HI��ƽ��Ũ�� c���ﵽƽ���ʱ�� d��ƽ��ʱH2���������
(3)ʵ������Zn��ϡ������ȡH2����Ӧʱ��Һ��ˮ�ĵ���ƽ��____�ƶ�������������ҡ��������� ���������������Լ��е�____������H2�����ʽ�����
a��NaNO3 b��CuSO4 c��Na2SO4 d��NaHSO3
 2HI(g)��ƽ�ⳣ��K=____ ��ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������____��ԭ����2����
2HI(g)��ƽ�ⳣ��K=____ ��ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������____��ԭ����2����a��ƽ�ⳣ�� b��HI��ƽ��Ũ�� c���ﵽƽ���ʱ�� d��ƽ��ʱH2���������
(3)ʵ������Zn��ϡ������ȡH2����Ӧʱ��Һ��ˮ�ĵ���ƽ��____�ƶ�������������ҡ��������� ���������������Լ��е�____������H2�����ʽ�����
a��NaNO3 b��CuSO4 c��Na2SO4 d��NaHSO3
(1)c
(2)0.1 mol��L-1��min-1��64��b
(3)���ң�b
(2)0.1 mol��L-1��min-1��64��b
(3)���ң�b

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
 ��2010?ɽ������һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��2010?ɽ������һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ�� H2+I2
H2+I2 2HI��g����ƽ�ⳣ��K=
2HI��g����ƽ�ⳣ��K= ��һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��












 H2��I2(g)
H2��I2(g) 