题目内容
14.下列化学反应的离子方程式不正确的是( )| A. | 向NaHSO3溶液中加入NaHSO4溶液:HSO3-+H+═H2O+SO2↑ | |
| B. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:Al3++2Ba2++4OH-+2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 小苏打溶液与乙酸溶液混合 HCO3-+CH3COOH═CH3COO-+H2O+CO2↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
分析 A.反应生成硫酸钠、水、二氧化硫;
B.物质的量比为1:2,反应生成硫酸钡、氢氧化铝和一水合氨;
C.反应生成乙酸钠、水、二氧化碳;
D.反应生成氢氧化铝和氯化铵.
解答 解:A.向NaHSO3溶液中加入NaHSO4溶液的离子反应为HSO3-+H+═H2O+SO2↑,故A正确;
B.0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合的离子反应为NH4++Al3++2Ba2++4OH-+2SO42-═2BaSO4↓+Al(OH)3↓+NH3•H2O,故B错误;
C.小苏打溶液与乙酸溶液混合的离子反应为HCO3-+CH3COOH═CH3COO-+H2O+CO2↑,故C正确;
D.AlCl3溶液中加入过量氨水的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D正确;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
2.设NA表示阿伏加德罗常数的值,下列说法正确的是( )


| A. | 常温下,17gOH-离子中含有电子数目为8NA | |
| B. | 78g苯含有C=C双键的数目为3NA | |
| C. | 标准状况下,11.2L乙烯中含有共用电子对数目3NA | |
| D. | 常温下,0.1mol SiC晶体(如右上图)中所含Si-C的数目为0.4NA |
19.某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.实验一制取氯酸钾和氯水利用如图1所示的实验装置进行实验.

(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤.该实验操作过程需要的玻璃仪器有胶头滴管、烧杯外,还需要的玻璃仪器是漏斗、玻璃棒.
(2)若对调B和C装置的位置,能(填“能”或“不能”)提高B中氯酸钾的产率.
实验二 氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
①系列a实验的实验目的是研究反应体系中硫酸浓度对反应产物的影响.
②设计1号试管实验的作用是硫酸浓度为0的对照实验.
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为ClO3-+6I-+6H+=Cl-+3I2+3H2O.
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用图2装置,加热15.0ml饱和氯水试样,测定产生气体的体积.此方案是否可行否(填“是”或“否”)
(5)另一小组研究出的方案是,量取一定量的试样,加入足的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,还需进行的操作是过滤、洗涤、干燥、称量沉淀质量
已知:次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-.

(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤.该实验操作过程需要的玻璃仪器有胶头滴管、烧杯外,还需要的玻璃仪器是漏斗、玻璃棒.
(2)若对调B和C装置的位置,能(填“能”或“不能”)提高B中氯酸钾的产率.
实验二 氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水 | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
②设计1号试管实验的作用是硫酸浓度为0的对照实验.
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为ClO3-+6I-+6H+=Cl-+3I2+3H2O.
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用图2装置,加热15.0ml饱和氯水试样,测定产生气体的体积.此方案是否可行否(填“是”或“否”)
(5)另一小组研究出的方案是,量取一定量的试样,加入足的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,还需进行的操作是过滤、洗涤、干燥、称量沉淀质量
已知:次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-.
6.下列关于同系物的说法错误的是
① 和
和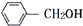 互为同系物,均可以与金属钠反应.
互为同系物,均可以与金属钠反应.
②苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色.
③同系物在水中的溶解性相同,苯的同系物都难溶于水,乙醇的同系物都易溶于水.
④烷烃的密度随分子量增大而增大,液态烷烃的密度小于水的密度,固态烷烃的密度大于水的密度.
⑤同系物的分子式可以用一个通式概括,符合通式CnH2nO的物质是饱和一元醛.
⑥乙二醇和丙三醇互为同系物.( )
①
 和
和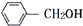 互为同系物,均可以与金属钠反应.
互为同系物,均可以与金属钠反应.②苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色.
③同系物在水中的溶解性相同,苯的同系物都难溶于水,乙醇的同系物都易溶于水.
④烷烃的密度随分子量增大而增大,液态烷烃的密度小于水的密度,固态烷烃的密度大于水的密度.
⑤同系物的分子式可以用一个通式概括,符合通式CnH2nO的物质是饱和一元醛.
⑥乙二醇和丙三醇互为同系物.( )
| A. | .③④⑤⑥ | B. | ①②③④ | C. | ①②⑤⑥ | D. | ①②③④⑤⑥ |
3.如图是维生素A的结构简式,关于它的说法中不正确的是( )


| A. | 1个分子中有5个碳碳双键 | |
| B. | 能使高锰酸钾溶液褪色 | |
| C. | 能与碳酸钠溶液反应放出CO2气体 | |
| D. | 能发生加成反应、氧化反应、置换反应 |
4.下列物质在一定条件下能导电,但不是电解质的是( )
| A. | 铝 | B. | 食盐 | C. | 硫酸 | D. | 蔗糖 |
