题目内容
按照HCl、( )、Ca(ClO)2、Cl2O5、HClO4的排列规律,选出一种适当的物质填入括号.
分析:由信息可知,HCl中Cl为-1价,Ca(ClO)2中Cl为+1价,Cl2O5中Cl为+5价,HClO4中Cl为+7价,按照元素的化合价由低到高排列,以此来解答.
解答:解:由信息可知,HCl中Cl为-1价,Ca(ClO)2中Cl为+1价,Cl2O5中Cl为+5价,HClO4中Cl为+7价,按照元素的化合价由低到高排列,
A.Cl2中Cl元素的化合价为0,处于-1和+1之间,故A选;
B.NaClO中Cl元素的化合价为+1价,故B不选;
C.Cl2O7中Cl元素的化合价为+7价,故C不选;
D.NaCl中Cl元素的化合价为-1价,故D不选;
故选A.
A.Cl2中Cl元素的化合价为0,处于-1和+1之间,故A选;
B.NaClO中Cl元素的化合价为+1价,故B不选;
C.Cl2O7中Cl元素的化合价为+7价,故C不选;
D.NaCl中Cl元素的化合价为-1价,故D不选;
故选A.
点评:本题考查Cl元素的化合价及规律性分析,明确元素的化合价是解答本题的关键,题目较简单.

练习册系列答案
相关题目
H2O2是实验室常用的一种化学试剂。某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
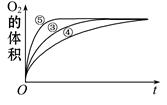
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析下图能够得出的结论是 。
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如下图所示的实验装置进行实验。
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是 。

(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为 ;