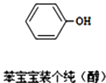
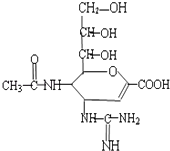
题目内容
【题目】按要求填空:
(1)分子中有18个氢原子的链烷烃的分子式:
(2)2,3﹣二甲基﹣1﹣丁烯的结构简式:
(3)用系统法命名: 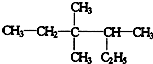
(4)CH2=CH﹣C≡CH结构中碳原子轨道的杂化方式是
(5)有机物的结构可用“键线式”简化表示.如CH3﹣CH=CH﹣CH3可简写为 ![]() ,
,  的分子式为 , 1mol该烃完全燃烧,需要标准状况下氧气升;该烃的一溴取代物有种.
的分子式为 , 1mol该烃完全燃烧,需要标准状况下氧气升;该烃的一溴取代物有种.
【答案】
(1)C8H18
(2)CH2=C(CH3)CH(CH3)CH3
(3)3,3,4﹣三甲基已烷
(4)sp2和sp
(5)C10H16;313.6;2
【解析】解:(1)分子中有18个氢原子的链烷烃为辛烷,分子式为:C8H18 , 所以答案是:C8H18;(2)2,3﹣二甲基﹣1﹣丁烯的结构简式为:CH2=C(CH3)CH(CH3)CH3 , 所以答案是:CH2=C(CH3)CH(CH3)CH3;(3)  最长碳连为6个碳,3号位有2个甲基,4号位有1个甲基,故名称为3,3,4﹣三甲基已烷; 所以答案是:3,3,4﹣三甲基已烷;(4)碳碳双键采用sp2杂化,碳碳叁键采用sp杂化,故CH2=CH﹣C≡CH结构中碳原子轨道的杂化方式为sp2和sp,所以答案是:sp2和sp;(5)
最长碳连为6个碳,3号位有2个甲基,4号位有1个甲基,故名称为3,3,4﹣三甲基已烷; 所以答案是:3,3,4﹣三甲基已烷;(4)碳碳双键采用sp2杂化,碳碳叁键采用sp杂化,故CH2=CH﹣C≡CH结构中碳原子轨道的杂化方式为sp2和sp,所以答案是:sp2和sp;(5)  的分子式为C10H16;1molC10H16完全燃烧,需要氧气的物质的量为:10+
的分子式为C10H16;1molC10H16完全燃烧,需要氧气的物质的量为:10+ ![]() =14mol,标准状况下的体积为:22.4×14=313.6L;
=14mol,标准状况下的体积为:22.4×14=313.6L;  含有2种不同的氢原子,故它的一溴取代物有2种;
含有2种不同的氢原子,故它的一溴取代物有2种;
所以答案是:C10H16;313.6;2.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目