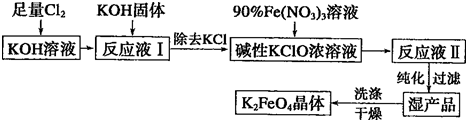
题目内容
 实验室要配制200mL 1mol/L NaOH溶液,请回答下列问题.
实验室要配制200mL 1mol/L NaOH溶液,请回答下列问题.(1)用托盘天平称取氢氧化钠,其质量为
(2)实验开始前,需要检查容量瓶是否
(3)下列主要操作步骤的正确顺序是
①称取一定量的氢氧化钠,放入烧杯中,用适量的蒸馏水溶解;
②用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2至3次,洗涤液转移到容量瓶中.
(4)在配制过程中,其他操作都正确,下列操作会引起所配溶液浓度偏低的是:
①溶解NaOH固体的过程中,有少量溶液溅出烧杯
②容量瓶不干燥,含有少量蒸馏水
③用于溶解NaOH的烧杯、玻璃棒未洗涤
④定容摇匀后发现液体体积小于刻度线,未补加少量蒸馏水至刻度线
(5)如图是该同学转移溶液的示意图,图中的错误是
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据m=C×V×M计算溶质的质量;
(2)容量瓶使用前需要检漏;
(3)实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序;
(4)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(5)依据操作判断正确与否.
(2)容量瓶使用前需要检漏;
(3)实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序;
(4)根据c=
| n |
| V |
(5)依据操作判断正确与否.
解答:
解:(1)实验中应选取容量瓶的规格为200mL,m=CVM=1mol/L×0.2L×40g/mol=8.0g,故答案为:8.0;
(2)容量瓶使用前应检验是否漏水,故答案为:漏水;
(3)实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序,所以其排列顺序为:①③⑤②④,故答案为:①③⑤②④;
(4)①溶解NaOH固体的过程中,有少量溶液溅出烧杯,导致氢氧化钠的物质的量减小,故偏小;
②容量瓶不干燥,含有少量蒸馏水,不影响;
③用于溶解NaOH的烧杯、玻璃棒未洗涤,导致氢氧化钠物质的量减小,故偏小
④定容摇匀后发现液体体积小于刻度线,未补加少量蒸馏水至刻度线,操作正确,不影响,
故答案为:①③;
(5)图中为转移液体操作,错误由:未用玻璃棒引流;未采用200 mL容量瓶,故答案为:未用玻璃棒引流、未采用200 mL容量瓶.
(2)容量瓶使用前应检验是否漏水,故答案为:漏水;
(3)实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序,所以其排列顺序为:①③⑤②④,故答案为:①③⑤②④;
(4)①溶解NaOH固体的过程中,有少量溶液溅出烧杯,导致氢氧化钠的物质的量减小,故偏小;
②容量瓶不干燥,含有少量蒸馏水,不影响;
③用于溶解NaOH的烧杯、玻璃棒未洗涤,导致氢氧化钠物质的量减小,故偏小
④定容摇匀后发现液体体积小于刻度线,未补加少量蒸馏水至刻度线,操作正确,不影响,
故答案为:①③;
(5)图中为转移液体操作,错误由:未用玻璃棒引流;未采用200 mL容量瓶,故答案为:未用玻璃棒引流、未采用200 mL容量瓶.
点评:本题考查一定物质的量浓度溶液的配制,难度不大,注意容量瓶规格的选取方法、误差的判断方法,为易错点.

练习册系列答案
相关题目
下列实验现象的描述不正确的是( )
| A、氢气在氯气中燃烧发出苍白色火焰,在瓶口有白雾生成 |
| B、红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟,加入少量水形成蓝色溶液 |
| C、金属Na在氯气中燃烧产生淡黄色的烟 |
| D、红热的铁丝在氯气中燃烧产生红棕色的烟 |
0.01mol氯化铬(CrCl3?6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀则此配合物可能是( )
| A、[Cr(H2O)6]Cl3 |
| B、[Cr(H2O)5Cl]Cl2 |
| C、[Cr(H2O)4Cl2]Cl |
| D、[Cr(H2O)3Cl3] |
用NaOH固体配制1mol/L的NaOH溶液,下列操作和说法中正确的是( )
| A、配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果 |
| B、称量时,将固体NaOH放在托盘天平左盘纸片上 |
| C、固体溶解后冷却到室温,然后将溶解后溶液转移到容量瓶中,立即向容量瓶中直接加水稀释到刻度线 |
| D、将40gNaOH固体溶于1 L水中可配成1mol/L的NaOH溶液 |
在汽车加油站见到的油罐车上,所贴有的危险化学品标志是( )
A、 |
B、 |
C、 |
D、 |
下列说法中正确的是( )
| A、难溶电解质的Ksp越小,溶解度就一定越小 |
| B、一般认为沉淀离子浓度小于1.0×10-5 mol/L时,沉淀就达完全 |
| C、用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) |
| D、向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 |
下列离子方程式只能表示一个化学反应的是( )
| A、H++OH-=H2O |
| B、Cl-+Ag+=AgCl↓ |
| C、Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓ |
| D、H++SO42-+OH-+Ba2+=BaSO4↓+H2O |