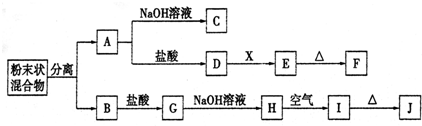
题目内容
5.(1)甲烷(CH4)的摩尔质量为16g/mol;(2)8g CH4中约含有3.01×1023个分子、含有5mol电子,在标准状况下所占的体积约为11.2L;
(3)所含原子数相等的甲烷和氨气(NH3)的质量比为64:85.
分析 (1)摩尔质量以g/mol为单位,在数值上等于其相对分子质量;
(2)根据n=$\frac{m}{M}$计算甲烷物质的量,根据N=nNA计算甲烷分子数目,电子物质的量为甲烷的10倍,根据V=nVm计算甲烷的体积;
(3)根据分子与分子中原子的物质的量关系,求出CO和CO2的物质的量之比,然后求出质量比.
解答 解:(1)甲烷的相对分子质量为16,则其摩尔质量为16g/mol,故答案为:16g/mol;
(2)8g甲烷物质的量为$\frac{8g}{16g/mol}$=0.5mol,甲烷分子数目为0.5mol×6.02×1023 mol-1=3.01×1023,含有电子物质的量为0.5mol×10=5mol,标况下甲烷的体积为0.5mol×22.4L/mol=11.2L,
故答案为:3.01×1023;5;11.2;
(3)因为一个甲烷分子中含有5个原子,一个NH3分子中含有4个原子,所以含原子数相等的甲烷和氨气的物质的量之比为4:5,则甲烷和氨气质量比为$\frac{4×16}{5×17}$=64:85;
故答案为:64:85.
点评 本题考查物质的量的有关计算,明确质量与物质的量的关系、体积与物质的量的关系是解答本题的关键.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
19. 把在空气中久置的铝片5.0g投入盛有50mL 0.1mol•L-1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( )
把在空气中久置的铝片5.0g投入盛有50mL 0.1mol•L-1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( )
 把在空气中久置的铝片5.0g投入盛有50mL 0.1mol•L-1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( )
把在空气中久置的铝片5.0g投入盛有50mL 0.1mol•L-1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( )| A. | O→a段不产生氢气是因为表面的氧化物隔离了铝和稀盐酸 | |
| B. | b→c段产生氢气的速率增加较快的主要原因之一是温度升高 | |
| C. | t=c时刻,反应处于平衡 | |
| D. | t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降 |
20.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
| A. |  干燥Cl2 | B. |  分离乙醇和乙酸 | ||
| C. |  石油的蒸馏 | D. |  分离I2 |
10. 有a、b、c、d四瓶不同物质的溶液,它们分别是Ba(OH)2溶液、Na2CO3溶液、MgCl2溶液和稀硫酸中的某一种(物质的量浓度均为0.2mol•L-1).为了鉴别以上物质,操作如下:各取少量溶液进行两两混合,实验现象如右表所示,表中“↓”表示生成沉淀或微溶化合物,“↑”表示生成气体,“-”表示观察不到明显现象.下列说法正确的是( )
有a、b、c、d四瓶不同物质的溶液,它们分别是Ba(OH)2溶液、Na2CO3溶液、MgCl2溶液和稀硫酸中的某一种(物质的量浓度均为0.2mol•L-1).为了鉴别以上物质,操作如下:各取少量溶液进行两两混合,实验现象如右表所示,表中“↓”表示生成沉淀或微溶化合物,“↑”表示生成气体,“-”表示观察不到明显现象.下列说法正确的是( )
 有a、b、c、d四瓶不同物质的溶液,它们分别是Ba(OH)2溶液、Na2CO3溶液、MgCl2溶液和稀硫酸中的某一种(物质的量浓度均为0.2mol•L-1).为了鉴别以上物质,操作如下:各取少量溶液进行两两混合,实验现象如右表所示,表中“↓”表示生成沉淀或微溶化合物,“↑”表示生成气体,“-”表示观察不到明显现象.下列说法正确的是( )
有a、b、c、d四瓶不同物质的溶液,它们分别是Ba(OH)2溶液、Na2CO3溶液、MgCl2溶液和稀硫酸中的某一种(物质的量浓度均为0.2mol•L-1).为了鉴别以上物质,操作如下:各取少量溶液进行两两混合,实验现象如右表所示,表中“↓”表示生成沉淀或微溶化合物,“↑”表示生成气体,“-”表示观察不到明显现象.下列说法正确的是( )| A. | a是稀硫酸 | B. | b可能是Na2CO3溶液 | ||
| C. | c是Ba(OH)2溶液 | D. | d是MgCl2溶液 |
17.去甲肾上腺素可以调控动物机体的植物性神经功能.其结构简式如图所示.下列说法正确的是( )

| A. | 每个去甲肾上腺素分子中含有 3 个酚羟基 | |
| B. | 去甲肾上腺素分子难溶于水 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
14.下列离子在溶液中能大量共存,且溶液加入镁粉有气体产生的是( )
| A. | Ba2+、Na+、NO3-、I- | B. | H+、Ag+、NO3-、HCO3- | ||
| C. | Fe3+、Na+、S2-、Cl- | D. | Al3+、K+、Br-、SO42- |
15.如表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃).
回答下列问题:
(1)由如表分析,若①CH3COOH ②HCO3-③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为①④③②(须填编号).
(2)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)=c(NH4+)(填“>”、“=”或“<”).
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是CD.
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
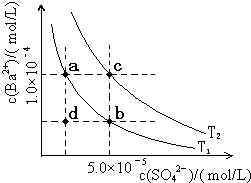 (5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
①T1< T2(填>、=、<);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是ABC.
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点.
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3•H2O | NH3•H2O?NH4++OH- | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2?Mg2++2OH- | 5.6×10-12 |
(1)由如表分析,若①CH3COOH ②HCO3-③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为①④③②(须填编号).
(2)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)=c(NH4+)(填“>”、“=”或“<”).
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是CD.
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
 (5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:①T1< T2(填>、=、<);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是ABC.
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点.