题目内容
4.用含淀粉的物质制备陈醋(醋酸)的主要过程,可用化学方程式表示为:(1)(C6H10O5)n+nH2O$\stackrel{稀硫酸}{→}$nC6H12O6
(2)$\stackrel{{C}_{6}{H}_{12}{O}_{6}}{葡萄糖}$$\stackrel{酶}{→}$2CH3CH2OH+2CO2↑
(3)2CH3CH2OH+O2$→_{△}^{Ag或者Cu}$2CH3CHO+2H2O
(4)2CH3CHO$\stackrel{酶}{→}$2CH3COOH
检验所酿的陈醋中是否含有淀粉的方法是用碘液来检验食醋中是否含有淀粉,若碘液变蓝色,说明含有淀粉.
分析 淀粉为多糖,水解生成葡萄糖,葡萄糖在酶的催化作用下分解生成乙醇和二氧化碳,乙醇催化氧化生成乙醛,乙醛氧化生成乙酸,淀粉遇到淀粉变蓝色,据此解答.
解答 解:(1)淀粉为多糖,淀粉在稀硫酸作用下水解生成葡萄糖,水解的方程式为(C6H10O5)n+nH2O$\stackrel{稀硫酸}{→}$nC6H12O6,
故答案为:(C6H10O5)n+nH2O$\stackrel{稀硫酸}{→}$nC6H12O6;
(3)乙醇在铜或银做催化剂条件下发生催化氧化生成乙醛和水,
反应的方程式为2CH3CH2OH+O2$→_{△}^{Ag或者Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Ag或者Cu}$2CH3CHO+2H2O;
(4)淀粉的特性是淀粉遇碘液变蓝色,因此可以用碘液来检验食醋中是否含有淀粉,若碘液变蓝色,说明含有淀粉;
故答案为:用碘液来检验食醋中是否含有淀粉,若碘液变蓝色,说明含有淀粉.
点评 本题考查了化学方程式的书写,物质的检验,明确淀粉、葡萄糖、乙醇、乙醛的性质是解题关键,注意淀粉的特性及检验方法,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
14.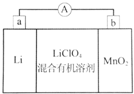 锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )
 锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池负极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 该电池电解液可用LiClO4水溶液代替 | |
| D. | 从废旧锂锰电池的正极材料中可回收金属Li、Mn |
12.溶液与人类的生活息息相关,溶液的配制是日常生活和科学实验中的常见操作.下表是硫酸溶液和氨水的密度及其溶质质量分数对照表(20℃).请仔细分析列式计算:
(1)取12%的硫酸溶液100毫升可配制成6%的硫酸溶液多少克?
(2)向200毫升28%的氨水中加入240毫升水,摇匀,所得溶液体积是多少毫升?(结果保留一位小数)
| 溶液中溶质质量分数 | 4% | 12% | 16% | 24% | 28% |
| 硫酸溶液的密度/(克/厘米3) | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/(克/厘米3) | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
(2)向200毫升28%的氨水中加入240毫升水,摇匀,所得溶液体积是多少毫升?(结果保留一位小数)
19.常温常压下,下列某气体与足量氧气混合后的体积为4L,充分燃烧后恢复到原状况体积变为2L,则该气体可能是( )
| A. | C4H10 | B. | C3H8 | C. | C2H6 | D. | CH4 |
5.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行以下五项操作:①过滤;②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液,正确的是( )
| A. | ⑤②④①③ | B. | ④①②⑤③ | C. | ①④②⑤③ | D. | ②④⑤①③ |
12.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数c>d | B. | 离子的还原性Y2->Z- | ||
| C. | 离子半径aW3+>cY2- | D. | 原子半径X<W |
9.已知元素的某种性质“x”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的x的数值:
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的x差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的x的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强).
(3)简述第二周期元素(除稀有气体外)的x的数值大小与原子半径之间的关系:原子半径越小,X的数值越大.
(4)请你预测Br与I元素的x数值的大小关系:Br>I(填“>”、“=”或“<”).
(5)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
| 元素 | Al | B | Be | C | Cl | F | Li |
| x的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| x的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
(1)经验规律告诉我们:当形成化学键的两原子相应元素的x差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的x的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强).
(3)简述第二周期元素(除稀有气体外)的x的数值大小与原子半径之间的关系:原子半径越小,X的数值越大.
(4)请你预测Br与I元素的x数值的大小关系:Br>I(填“>”、“=”或“<”).
(5)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
10.下列各组物质中属于同分异构体的是( )
| A. | 葡萄糖和果糖 | B. | 甲烷和乙烷 | C. | 16O和18O | D. | 淀粉和纤维素 |