题目内容
14.0.5mol•L-1的NaCl溶液中混有Na2CO3,向该溶液中滴加适量的BaCl2.滤液中NaCl的物质的量浓度为( )| A. | 小于0.5 mol•L-1 | B. | 等于0.5 mol•L-1 | C. | 大于0.5 mol•L-1 | D. | 无法确定 |
分析 尽管加入BaCl2溶液后过滤,除去了BaCl2,增加了NaCl,但由于所加溶液体积或过滤后溶液体积不知,所以滤液中NaCl的物质的量浓度也就无法确定.
解答 解:.5mol•L-1的NaCl溶液中混有Na2CO3,向该溶液中滴加适量的BaCl2,由于所加溶液体积或过滤后溶液体积不知,所以无法确定滤液中NaCl的物质的量浓度,
故选D.
点评 本题考查了物质的量浓度的计算与判断,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意本题中硫化钠溶液、氯化钡溶液、滤液体积未知,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为11;Y、Z在同一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍.下列说法中正确的是( )
| A. | 离子半径:Y>X | B. | 气态氢化物的稳定性:Z>X | ||
| C. | Y的氧化物中含离子键 | D. | Z的氧化物对应的水化物是强酸 |
19.在一定条件下,反应CO+NO2?CO2+NO△H=a kJ/mol达到平衡后,降低温度,混和气体的颜色变浅.下列判断正确的是( )
| A. | a<0 | |
| B. | 降低温度,各物质的浓度不变 | |
| C. | 降低温度,CO的平衡转化率降低 | |
| D. | 使用催化剂能加快反应速率并提高反应物的平衡转化率 |
5.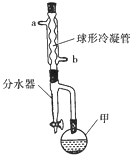 乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.
乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.
合成反应:
在甲中加入20g异戊醇和少量碎瓷片,在不断搅拌下加入2mL浓硫酸,冷却后加入100g稍过量的冰醋酸,再加入环己烷(能与产物形成共沸混合物,不参加反应).安装带有分水器(预装有一定量的水)的冷凝回流装置,球形冷凝管中通入冷却水,用甘油浴缓慢加热仪器甲,冷凝回流一段时间.
分离提纯:
将反应粗产品倒入分液漏斗中,分别用少量10% Na2CO3溶液分两次洗涤.分去水层,向有机层中加入无水硫酸镁固体,静置一段时间后分离出液体,最后蒸馏除去环己烷得到纯净的乙酸异戊酯13g.
已知下列物质的沸点和密度:
请回答下列问题:
(1)合成乙酸异戊酯的化学方程式为CH3COOH+(CH3)2CHCH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH(CH3)2+H2O.
(2)仪器甲的名称是圆底烧瓶.
(3)分水器可将仪器甲中产生的水分离出来,目的是提高反应物的转化率或生成物的产率;按照球形冷凝管中冷却水的流向应该由b(填“a”或“b”)口进水.
(4)本实验使用甘油浴加热的优点有便于控制反应温度、使圆底烧瓶受热均匀 (答出两点即可).
(5)当观察到分水器中出现水层高度(或水的体积、液面对应刻度)不再变化现象时,可停止加热仪器甲,终止合成反应过程.
(6)用10%Na2CO3溶液洗涤的作用是ad.
a、除去未反应完的醋酸 b、提高异戊醇的转化率
c、与异戊醇反应,除去杂质 d、降低乙酸异戊酯在水中的溶解能力
(7)本实验中无水硫酸镁的作用是作干燥剂.
(8)本实验中异戊醇的转化率为44%.
 乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.
乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.合成反应:
在甲中加入20g异戊醇和少量碎瓷片,在不断搅拌下加入2mL浓硫酸,冷却后加入100g稍过量的冰醋酸,再加入环己烷(能与产物形成共沸混合物,不参加反应).安装带有分水器(预装有一定量的水)的冷凝回流装置,球形冷凝管中通入冷却水,用甘油浴缓慢加热仪器甲,冷凝回流一段时间.
分离提纯:
将反应粗产品倒入分液漏斗中,分别用少量10% Na2CO3溶液分两次洗涤.分去水层,向有机层中加入无水硫酸镁固体,静置一段时间后分离出液体,最后蒸馏除去环己烷得到纯净的乙酸异戊酯13g.
已知下列物质的沸点和密度:
| 甘油 | 环已烷 | 乙酸 | 异戊醇 | |
| 沸点/℃ | 290 | 80.7 | 117.9 | 132.5 |
| 密度/g•cm-3 | 1.26 | 0.78 | 1.05 | 0.81 |
(1)合成乙酸异戊酯的化学方程式为CH3COOH+(CH3)2CHCH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH(CH3)2+H2O.
(2)仪器甲的名称是圆底烧瓶.
(3)分水器可将仪器甲中产生的水分离出来,目的是提高反应物的转化率或生成物的产率;按照球形冷凝管中冷却水的流向应该由b(填“a”或“b”)口进水.
(4)本实验使用甘油浴加热的优点有便于控制反应温度、使圆底烧瓶受热均匀 (答出两点即可).
(5)当观察到分水器中出现水层高度(或水的体积、液面对应刻度)不再变化现象时,可停止加热仪器甲,终止合成反应过程.
(6)用10%Na2CO3溶液洗涤的作用是ad.
a、除去未反应完的醋酸 b、提高异戊醇的转化率
c、与异戊醇反应,除去杂质 d、降低乙酸异戊酯在水中的溶解能力
(7)本实验中无水硫酸镁的作用是作干燥剂.
(8)本实验中异戊醇的转化率为44%.
6.下列分子中,键角最大的是( )
| A. | H2S | B. | H2O | C. | CCl4 | D. | NH3 |