题目内容
30℃时,在某硫酸铜溶液中加入27.5 g CuSO4或加入50.0 g CuSO4·5H2O,恢复到30℃时,都刚好成为饱和溶液,则30℃时CuSO4的溶解度是
- A.4.5 g
- B.22.5 g
- C.25 g
- D.32 g
C
50.0 g CuSO4·5H2O中CuSO4的质量为32g,结晶水的质量为18g,所以18g水中溶解 CuSO4形成饱和溶液;根据溶解度的概念可得30℃时CuSO4的溶解度是:
CuSO4形成饱和溶液;根据溶解度的概念可得30℃时CuSO4的溶解度是: ;
;
50.0 g CuSO4·5H2O中CuSO4的质量为32g,结晶水的质量为18g,所以18g水中溶解
 CuSO4形成饱和溶液;根据溶解度的概念可得30℃时CuSO4的溶解度是:
CuSO4形成饱和溶液;根据溶解度的概念可得30℃时CuSO4的溶解度是: ;
; 
练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
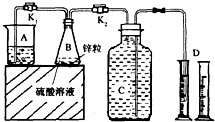 某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:
某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:| 实验序号 | 硫酸浓度 | 饱和硫酸铜溶液体积/mL | 反应达到平稳的时间/min | 第1分钟收集氢气体积/mL | 第2分钟收集氢气体积/mL | 第3分钟收集氢气体积/mL | … |
| 1 | 20% | 0 | 5.4 | 6.1 | 11.9 | 13.7 | … |
| 2 | 20% | 0.5 | 2.5 | 23.9 | 32.1 | 33.5 | … |
| 3 | 30% | 0.5 | 1.1 | 60.7 | 89.9 | 90.1 | … |
| 4 | a% | 3.0 | 0.8 | 55.7 | 66.0 | 61.4 | … |
(1)关闭K2、打开K1,观察到
(2)实验l、2是对比探究实验,分析上表,说明该对比探究实验的目的是
(3)细口瓶C的容积为V(mL),为了使加入的锌(质量bg)不浪费,在C中还留有
| 2 |
| 5 |
(4)实验4是研究饱和硫酸铜溶液的体积对实验的影响,a值应为
A. 20 B.30 C.27 D. 40
(5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验
(6)从实验后的废液中回收皓矾(ZnSO4?7H2O)所需的实验操作步骤是
(7)查资料得知:Cu++Cl-═CuCl↓.
湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是
|
30℃时,在某硫酸铜溶液中加入27.5 g CuSO4或加入50.0 g CuSO4·5H2O,恢复到30℃时,都刚好成为饱和溶液,则30℃时CuSO4的溶解度是 | |
| [ ] | |
A. |
4.5 g |
B. |
22.5 g |
C. |
25 g |
D. |
32 g |
30℃时,在某硫酸铜溶液中加入27.5 g CuSO4或加入50.0 g CuSO4·5H2O,恢复到30℃时,都刚好成为饱和溶液,则30℃时CuSO4的溶解度是
| A.4.5 g | B.22.5 g | C.25 g | D.32 g |