题目内容
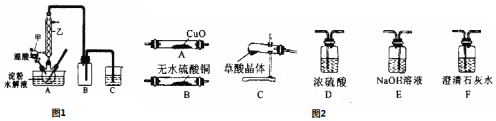
19.草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图1所示
(1)图1实验装置中仪器甲的名称为分液漏斗.
(2)检验淀粉是否水解完全所需要的试剂为:碘水或I2.
实验Ⅱ:探究草酸的不稳定性
甲组同学查阅资料得知:草酸晶体(H2C2O4•2H2O)100℃开始失水,150℃左右分解产生H2O、CO和CO2.试用图2中提供的仪器和试剂,设计一个实验,证明草酸晶体分解得到的混合气体中含有H2O、CO和CO2(加热装置和导管等在图中略去,部分装置可以重复使用).
请回答下列问题:
(3)仪器装置连接顺序为:C→B→F→E→F→D→A→F.
(4)若实验结束后测得A管质量减轻2.4g,则需分解草酸晶体的质量为18.9g.
(5)乙组同学查阅资料发现:草酸酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均是白色不溶物.通过进一步研究认为,草酸蒸汽与石灰水反应生成草酸钙白色沉淀,对实验有干扰,因此提出需要在检验CO2装置之前增加一个装有D的洗气装置.(填写字母编号).
A.饱和碳酸氢钠溶液 B.氢氧化钠溶液 C.碳酸钠溶液 D.水.
分析 (1)仪器甲的名称为分液漏斗;
(2)淀粉遇碘变蓝色,在已经水解的淀粉溶液中滴加几滴碘液,溶液显蓝色,则证明淀粉没有完全水解,溶液若不显色,则证明淀粉完全水解;
(3)检验H2O、CO和CO2气体,首先应该用无水硫酸铜遇水蒸气变蓝,再利用二氧化碳能使澄清的石灰水变浑浊,一氧化碳检验还原性,能还原黑色的氧化铜,生成的二氧化碳用澄清的石灰水检验,据此根据水蒸气、二氧化碳和一氧化碳的性质进行排序;
(4)根据A管质量减轻2.4g利用差量法计算出产生的一氧化碳的物质的量,再根据草酸晶体分解的方程式计算求得;
(5)根据草酸蒸气和二氧化碳的性质来回答.
解答 解:(1)仪器甲的名称为分液漏斗,故答案为:分液漏斗;
(2)淀粉遇碘变蓝色,在已经水解的淀粉溶液中滴加几滴碘液,溶液显蓝色,则证明淀粉没有完全水解,溶液若不显色,则证明淀粉完全水解,故答案为:碘水或I2;
(3)为证明草酸的受热分解产物中含有H2O、CO2和CO,先首先将混合气体通入无水硫酸铜检验水蒸气,如果变蓝说明有水蒸气产生,再通入澄清的石灰水检验二氧化碳,如果澄清的石灰水变浑浊,则证明含有二氧化碳气体,再用氢氧化钠溶液吸收二氧化碳,再通入澄清的石灰水检验二氧化碳是否被除尽,然后再将洗气后的气体进行干燥,最后将气体再通过黑色的氧化铜装置,一氧化碳和黑色的氧化铜反应生成铜和二氧化碳,再用澄清的石灰水检验二氧化碳是否存在,如果澄清石灰水变浑浊,则证明该混合气体中含有一氧化碳,故答案为:B; E; F;
(4)A管质量减轻2.4g,根据 CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2 △m
1 16
0.15mol 2.4g
再根据H2C2O4•2H2O=3H2O+CO+CO2,得分解的草酸晶体为0.15mol,所以质量为:0.15mol×126g/mol=18.9g,故答案为:18.9;
(5)草酸分解的气体中含有CO2,用氢氧化钠溶液会将二氧化碳除去,无法进行下一步检验,故B错,草酸既然是酸,那么就会跟碳酸根、碳酸氢根发生反应放出CO2,对检验CO2产生干扰,故A、C错,故选:D.
点评 本题考查了实验设计,计算等,难度较大,注意检验二氧化碳和一氧化碳的混合物中,要先检验二氧化碳再检验是否除尽最后再检验一氧化碳,为易错点.

| A. | 500 ml,1mol/LFe2(SO4)3溶液和250mL 3mol/L的Na2SO4溶液所含硫酸根离子的物质的量浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2gNaHSO4晶体中阳离子和阴离子的总数为0.03NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中.Na+的物质的量浓度为lmol/L |
| A. | 涤纶、锦纶、蚕丝都属于合成纤维 | |
| B. | 塑料、液晶高分子和合成橡胶被称为三大合成材料 | |
| C. | 用于生产“尿不湿”的高吸水性树脂属于功能高分子材料 | |
| D. | 酚醛树脂是酚类物质和醛类物质加聚而成的高分子化合物 |
| A. | 明矾可以除去水中的悬浮颗粒等杂质,所以可以作净水剂 | |
| B. | 可用燃烧的方法鉴别羊毛围巾和合成纤维围巾 | |
| C. | 黄瓜含有丰富的维生素C,热锅爆炒可以减少维生素C的流失 | |
| D. | 石英玻璃纤维传导光的能力非常强,所以常用于制作光纤 |
①向饱和碳酸钠溶液中通入过量的CO2 ②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀氢氧化钠溶液 ④向硅酸钠溶液中逐滴加入过量的盐酸.
| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①③ |
| A. | 纯碱 | B. | 石灰石 | C. | 石英 | D. | 黏土 |

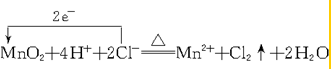 .
.