题目内容
在3种有机物 ①CH2=CH2、②CH3COOH、③CH4,能使紫色石蕊溶液变红的是 (填序号,下同),可用于合成聚乙烯塑料的是 ,可用作清洁能源的是 .
考点:甲烷的化学性质,乙酸的化学性质
专题:有机物的化学性质及推断
分析:含-COOH的有机物能使紫色石蕊溶液变红,乙烯中含双键可发生加聚反应生成聚乙烯,CH4是常见的清洁能源,以此来解答.
解答:
解:①CH2=CH2中含双键,可发生加聚反应生成聚乙烯塑料;
②CH3COOH中含-COOH,具有酸性,能使紫色石蕊溶液变红;
③CH4是常见的清洁能源,
故答案为:②;①;③.
②CH3COOH中含-COOH,具有酸性,能使紫色石蕊溶液变红;
③CH4是常见的清洁能源,
故答案为:②;①;③.
点评:本题考查有机物的结构与性质,把握官能团与性质的关系为解答的关键,侧重烯烃、羧酸性质的考查,注意官能团的判断,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
A、12C和14C的原子结构示意图均为 |
| B、在Na2O2和CaCl2中均含有共价键和离子键 |
C、结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D、电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
硝基苯中溶有少量CaCl2,适宜的提纯方法是( )
| A、过滤 | B、蒸馏 |
| C、分液 | D、纸上层析 |
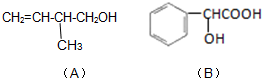 已知有机化合物A和B的结构简式分别为
已知有机化合物A和B的结构简式分别为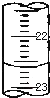 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤: