题目内容
已知X、Y、Z、T四种非金属元素,X、Y在反应时各结合一个电子形成稳定结构所放出的能量是Y>X,氢化物的稳定性是HX>HT,原子序数T>Z,其稳定结构的离子核外电子数相等,而其离子半径是Z>T.四种元素的非金属性从强到弱排列顺序正确的是( )
分析:X、Y两元素的原子分别获得一个电子形成稳定结构时,Y放出的能量大于X放出的能量.说明Y得电子的能量强于X,非金属性比X强;氢化物越稳定,则原子得电子能力越强,离子核外电子数相等,离子半径是Z>T,可以知道Z、T的氧化性强弱关系.
解答:解:X、Y在反应时各结合一个电子形成稳定结构所放出的能量是Y>X,说明Y得电子的能量强于X,所以氧化性是Y>X,
氢化物的稳定性是HX>HT,所以氧化性是X>T,
原子序数T>Z,其稳定结构的离子核外电子数相等,而其离子半径是Z>T,则氧化性是T>Z,
所以四种元素的非金属性从强到弱排列顺序是Y、X、T、Z.
故选D.
氢化物的稳定性是HX>HT,所以氧化性是X>T,
原子序数T>Z,其稳定结构的离子核外电子数相等,而其离子半径是Z>T,则氧化性是T>Z,
所以四种元素的非金属性从强到弱排列顺序是Y、X、T、Z.
故选D.
点评:本题考查学生元素周期律的有关知识,可以根据教材知识来回答,难度不大.

练习册系列答案
相关题目

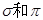 键的键数之比为 ,其化学性质
(填“活泼”或“稳定”):
键的键数之比为 ,其化学性质
(填“活泼”或“稳定”):