题目内容
已知H2O2是一种弱酸,在强碱性溶液中主要以HO2— 形式存在。目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-=2AlO2-+OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(右池中隔膜仅阻止气体通过,b、c、d均为惰性电极)。试回答下列问题
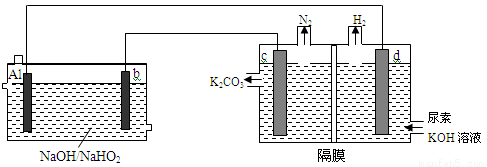
电极b是 极,电极反应式为 ,
(2)右池是 池,电极c的电极反应式为 ,
(3)通电2min后,Al电极质量减轻2.7g,则产生氮气的体积为 。(标准状况)
(10分)

正,HO2-+2e—+H2O=3OH— ,
(2)电解,CO(NH2)2-6 e—+8OH—=CO32—+N2+ 6H2O(3)1.12L
【解析】
试题分析:Al和b电极构成原是电池,Al活泼易失电子发生氧化反应作负极,b作正极;c和d电极构成电解池,c作阳极d作阴极,(1)电极b是正极,电极反应式为HO2-+2e—+H2O=3OH— ;(2)右池是电解池,电极c作阳极,电极反应式为CO(NH2)2-6 e—+8OH—=CO32—+N2+ 6H2O (3)由电子守恒,2.7gAl失电子0.3mol,生成氮气0.3mol/6=0.05mol,在标况下的体积为1.12L 。
考点:原电池、电解池、燃料电池

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:N2 (g)+3H2 (g) 2NH3 (g),△H= - 92. 6kJ/moL。实验测得起始、平衡时的有关数据如下表:
2NH3 (g),△H= - 92. 6kJ/moL。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器②中达平衡时放出的热量Q=23. 15kJ
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器①、②中反应的平衡常数相等
D.若容器①体积为0.5L,则平衡时放出的热量小于23. 15kJ


 C(g)+D,A和C均为无色气体,B和D的聚集状态未知,当反应到达平衡时,下列叙述不正确的是
C(g)+D,A和C均为无色气体,B和D的聚集状态未知,当反应到达平衡时,下列叙述不正确的是