题目内容
下表是甲城市某日空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究.
【探究实验】实验一:用下图所示装置进行实验.
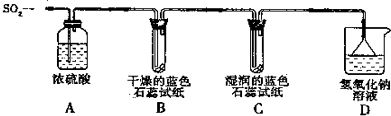
①A装置的作用是 (填“干燥”或“氧化”)SO2气体.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸,该酸的化学式是 .
③D装置的作用是 .若实验中向装置内通入标准状况下1.12LSO2气体,且NaOH溶液过量.最多能生成Na2SO3的物质的量为 mol.
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”、“=”或“<”),然后每隔1h测定其pH,发现pH逐渐变小,直至恒定.用化学方程式表示原因 .
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | II | 良 |
【探究实验】实验一:用下图所示装置进行实验.

①A装置的作用是
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变
③D装置的作用是
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH
考点:常见的生活环境的污染及治理,二氧化硫的污染及治理
专题:实验设计题,元素及其化合物
分析:实验一:①根据浓硫酸具有吸水性分析;
②二氧化硫气体不能使干燥的蓝色试纸变色;C装置内湿润的蓝色石蕊试纸变红,是由于生成了亚硫酸;
③二氧化硫是有毒的气体,可被氢氧化钠吸收;根据硫原子守恒求硫酸钠的物质的量;
实验二:根据溶液的酸碱性与pH的关系进行解答,当溶液的pH<7显酸性,当溶液的pH=7显中性,当溶液的pH>7显碱性;由于排放出来的SO2等气体溶于水后生成H2SO3,测得所得溶液的pH<7;
H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,亚硫酸易被空气中的氧气氧化,最终生成H2S04;
②二氧化硫气体不能使干燥的蓝色试纸变色;C装置内湿润的蓝色石蕊试纸变红,是由于生成了亚硫酸;
③二氧化硫是有毒的气体,可被氢氧化钠吸收;根据硫原子守恒求硫酸钠的物质的量;
实验二:根据溶液的酸碱性与pH的关系进行解答,当溶液的pH<7显酸性,当溶液的pH=7显中性,当溶液的pH>7显碱性;由于排放出来的SO2等气体溶于水后生成H2SO3,测得所得溶液的pH<7;
H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,亚硫酸易被空气中的氧气氧化,最终生成H2S04;
解答:
解:实验一:①二氧化硫与浓硫酸不反应,浓硫酸有吸水性,可以吸收二氧化硫中的水蒸气,所以浓硫酸的作用为:干燥二氧化硫气体,
故答案为:干燥;
②装置B内蓝色石蕊试纸虽然与二氧化硫气体接触,但却不变色,可以说明二氧化硫气体不能使干燥的蓝色试纸变色;C装置内湿润的蓝色石蕊试纸变红,说明试纸遇到了酸性物质,而二氧化硫并不能使试纸变红,因此,可推断二氧化硫与水作用形成了酸而使试纸变红,二氧化硫与水形成亚硫酸,
故答案为:红;H2SO3;
③二氧化硫是一种无色、有刺激性气味的有毒气体,它能与氢氧化钠溶液反应生成亚硫酸钠与水;反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,标准状况下2.24L SO2气体的物质的量为0.1mol,根据硫原子守恒,生成亚硫酸钠的物质的量为0.1mol,
故答案为:吸收多余SO2气体,避免污染空气;0.1;
实验二:
当溶液的pH<7显酸性,当溶液的pH=7显中性,当溶液的pH>7显碱性,S02与水反应生成了亚硫酸,溶液显酸性,所以溶液的pH<7,亚硫酸易被空气中的氧气氧化成硫酸,硫酸是强酸,酸性增强,所以PH变小,反应为,2H2SO3+O2=2H2SO4,
故答案为:<;2H2SO3+O2=2H2SO4;
故答案为:干燥;
②装置B内蓝色石蕊试纸虽然与二氧化硫气体接触,但却不变色,可以说明二氧化硫气体不能使干燥的蓝色试纸变色;C装置内湿润的蓝色石蕊试纸变红,说明试纸遇到了酸性物质,而二氧化硫并不能使试纸变红,因此,可推断二氧化硫与水作用形成了酸而使试纸变红,二氧化硫与水形成亚硫酸,
故答案为:红;H2SO3;
③二氧化硫是一种无色、有刺激性气味的有毒气体,它能与氢氧化钠溶液反应生成亚硫酸钠与水;反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,标准状况下2.24L SO2气体的物质的量为0.1mol,根据硫原子守恒,生成亚硫酸钠的物质的量为0.1mol,
故答案为:吸收多余SO2气体,避免污染空气;0.1;
实验二:
当溶液的pH<7显酸性,当溶液的pH=7显中性,当溶液的pH>7显碱性,S02与水反应生成了亚硫酸,溶液显酸性,所以溶液的pH<7,亚硫酸易被空气中的氧气氧化成硫酸,硫酸是强酸,酸性增强,所以PH变小,反应为,2H2SO3+O2=2H2SO4,
故答案为:<;2H2SO3+O2=2H2SO4;
点评:本题主要考查了酸雨的形成,掌握二氧化硫的化学性质结合题中的信息正确分析是解答的关键,题目难度不大.

练习册系列答案
相关题目
个别电解水设备推销商进行下列电解水实验:将纯净水与自来水进行对比,当电解器插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水中却冒出气泡并生成红褐色或灰绿色的絮状物.推销商趁此解释说自来水中含有对人体有毒有害的物质,长期饮用对身体有害.有关专家解释说,推销商用科学知识诱骗消费者,推销商做实验时用铁棒和铝棒作电极.下列判断错误的是( )
| A、推销商做实验时,用铁棒作阳极 |
| B、电解纯净水和自来水时的现象不同是因为纯净水和自来水所含电解质溶液浓度不同 |
| C、铝棒电极发生的电极反应为Al-3e-═Al3+ |
| D、电解自来水时出现“红褐色或灰绿色的絮状物”是因为产生了铁的氢氧化物 |
下列叙述正确的是( )
| A、使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| B、将混有乙烯的乙烷气体通入酸性高锰酸钾溶液,可得到纯净的乙烷气体 |
| C、将苯与溴水混合后,再加铁粉,即可制得溴苯 |
| D、在蔗糖溶液中加入几滴稀硫酸,水浴加热5 min,加入NaOH溶液至碱性,再加入银氨溶液并水浴加热 |
 利用太阳光分解水制氢是未来解决能源危机的理想方法之一.某研究小组设计了如下图所示的循环系统实验光分解水制氢.反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用.
利用太阳光分解水制氢是未来解决能源危机的理想方法之一.某研究小组设计了如下图所示的循环系统实验光分解水制氢.反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用.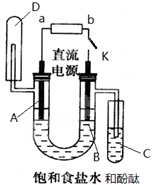 某实验兴趣小组利用如图装置进行电解饱和食盐水并检验其生成产物的实验,当图中开关K闭合片刻后,试填空:
某实验兴趣小组利用如图装置进行电解饱和食盐水并检验其生成产物的实验,当图中开关K闭合片刻后,试填空: