题目内容
6.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 在反应3Br2+3CO32-=5Br-+BrO3-+3CO2↑中,每生成3 mol CO2转移的电子数为5NA | |
| B. | 0.5 mol 甲基中电子数为5NA | |
| C. | 常温下,1 L 0.1 mol/L的NH4NO3溶液中氢原子总数为0.4NA | |
| D. | 常温常压下,22.4 L N2H4中N-H键数为4NA |
分析 A、反应3Br2+3CO32-=5Br-+BrO3-+3CO2↑转移5mol电子,生成3mol二氧化碳;
B、甲基不显电性;
C、硝酸铵溶液中,除了硝酸铵外,水也含H原子;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、反应3Br2+3CO32-=5Br-+BrO3-+3CO2↑转移5mol电子,生成3mol二氧化碳,故当生成3mol二氧化碳时,转移5NA个电子,故A正确;
B、甲基不显电性,故1mol甲基中含9NA个电子,则0.5mol甲基中含4.5NA个电子,故B错误;
C、硝酸铵溶液中,除了硝酸铵外,水也含H原子,故溶液中的H原子的个数多于0.4NA个,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L肼的物质的量小于1mol,则含有的N-H键个数小于4NA条,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
17.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
| A. | NO:0.001mol•L-1 | B. | H2O:0.002mol•L-1 | ||
| C. | NH3:0.002mol•L-1 | D. | O2:0.0025mol•L-1 |
14.铁铜单质及其化合物的应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:
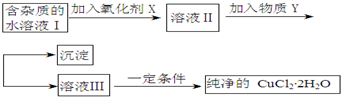
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
请回答下列问题:
(1)下列最适合作氧化剂X的是C
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入的物质Y是CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3]如果不用物质Y而直接用可溶性碱溶液不能 (填“能”或者“不能”)达到目的.若不能,试解释原因加碱使Fe3+沉淀的同时也能使Cu2+沉淀(若填“能”,此空不用回答)
(3)最后不能(填“能”或者“不能”)直接蒸发得到CuCl2•2H2O?若不能,应该如何操作才能得到CuCl2•2H2O应在HCl气流中加热蒸发结晶(若填“能”,此空不用回答)
(4)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀
(5)若向溶液Ⅱ中加入镁粉,产生的气体是氢气,试解释原因镁粉与氯化铁、氯化铜水解生成的氢离子反应生成氢气.

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
(1)下列最适合作氧化剂X的是C
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入的物质Y是CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3]如果不用物质Y而直接用可溶性碱溶液不能 (填“能”或者“不能”)达到目的.若不能,试解释原因加碱使Fe3+沉淀的同时也能使Cu2+沉淀(若填“能”,此空不用回答)
(3)最后不能(填“能”或者“不能”)直接蒸发得到CuCl2•2H2O?若不能,应该如何操作才能得到CuCl2•2H2O应在HCl气流中加热蒸发结晶(若填“能”,此空不用回答)
(4)若向溶液Ⅱ中加入碳酸钙,产生的现象是碳酸钙溶解,产生气泡和红褐色沉淀
(5)若向溶液Ⅱ中加入镁粉,产生的气体是氢气,试解释原因镁粉与氯化铁、氯化铜水解生成的氢离子反应生成氢气.
1.下列说法一定正确的是(NA表示阿伏加德罗常数)( )
| A. | 常温下4.4gN2O与标准状况下2.24LCH4均含有0.1NA个分子 | |
| B. | 78g金属钾(K)完全转化为超氧化钾(KO2)时,转移电子数为4NA | |
| C. | 0.1mol/L稀盐酸中,H+数目为0.1NA | |
| D. | 60g二氧化硅晶体中,含S-O键数目为2NA |
11.碱性锌锰电池是一种常见的一次电池,应用非常广泛,其工作时发生如下反应:Zn+2MnO2+H2O=2MnOOH+Zn(OH)2,下列说法正确的是( )
| A. | Zn为负极,MnO2为正极 | |
| B. | Zn为正极,MnO2为负极 | |
| C. | 工作时电子由MnO2经外电路流向Zn极 | |
| D. | Zn电极发生还原反应,MnO2电极发生氧化反应 |
除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是
选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
A | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
B | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
C | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
D | CO(H2) | 氧气 | 点燃 |