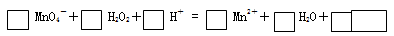题目内容
下列操作不能达到目的的是
选项 | 目的 | 操作 |
A. | 配制100 mL 1.0 mol/L CuSO4溶液 | 将25 g CuSO4·5H20溶于100 mL蒸馏水中 |
B. | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
C. | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
D. | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
A
【解析】
试题分析:A.100ml水的体积不等于溶液的体积,应将25gCuSO4?5H2O溶于水配成100ml溶液,A错误;B.KNO3在水中溶解度较大,而NaCl在水中的溶解度不大,可以利用溶解度差异采用冷却结晶的方法除去NaCl杂质,B正确。C.向酸性KMnO4溶液加H2O2可发生的离子反应为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,可将MnO4-完全转化为Mn2+,C正确;D.CO32-+Ca2+=CaCO3↓(白色)若出现白色浑浊,则NaCl溶液中混有Na2CO3,反之没有,D正确,选A。
考点:考查溶液配制,离子的转化及物质除杂与检验等实验基本常识。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目


 ,
, 与H+、Ca2+不能大量共存
与H+、Ca2+不能大量共存  CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O