题目内容
吸热反应N2(g)+O2(g)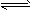 2NO(g),在2000℃时,K=6.2×10-4。2000℃时,在10L密闭容器内放入2.94×10-3mol NO、2.50×10-1mol N2和4.00×10-2mol O2,则下列说法正确的是
2NO(g),在2000℃时,K=6.2×10-4。2000℃时,在10L密闭容器内放入2.94×10-3mol NO、2.50×10-1mol N2和4.00×10-2mol O2,则下列说法正确的是
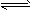 2NO(g),在2000℃时,K=6.2×10-4。2000℃时,在10L密闭容器内放入2.94×10-3mol NO、2.50×10-1mol N2和4.00×10-2mol O2,则下列说法正确的是
2NO(g),在2000℃时,K=6.2×10-4。2000℃时,在10L密闭容器内放入2.94×10-3mol NO、2.50×10-1mol N2和4.00×10-2mol O2,则下列说法正确的是 [ ]
A.此反应的初始状态为化学平衡状态
B.此反应的初始状态为非化学平衡状态,反应将正向进行
C.此反应的初始状态为非化学平衡状态,反应将逆向进行
D.无法判断
B.此反应的初始状态为非化学平衡状态,反应将正向进行
C.此反应的初始状态为非化学平衡状态,反应将逆向进行
D.无法判断
C

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时,K=6.2×10-4。2000℃时,在10L密闭容器内放入2.94×10-3mol NO、2.50×10-1mol N2和4.00×10-2mol O2,则下列说法正确的是
2NO(g),在2000℃时,K=6.2×10-4。2000℃时,在10L密闭容器内放入2.94×10-3mol NO、2.50×10-1mol N2和4.00×10-2mol O2,则下列说法正确的是
| A.此反应的初始状态为化学平衡状态 |
| B.此反应的初始状态为非化学平衡状态,反应将正向进行 |
| C.此反应的初始状态为非化学平衡状态,反应将逆向进行 |
| D.无法判断 |
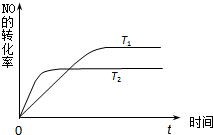 ①由此推知,反应 N2(g)+O2(g)?2NO(g)为(填“吸热”或“放热”)
①由此推知,反应 N2(g)+O2(g)?2NO(g)为(填“吸热”或“放热”)