题目内容
 如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:(1)p为
(2)C为
(3)C极的电极方程式是
(4)当电路中通过0.004mol电子时,B电极上沉积金属X的质量为0.128g,则此金属的摩尔质量为
(5)当反应进行一段时间后,A、B电极附近溶液的pH
(2)电解硫酸溶液时,阳极上氢氧根离子放电,阴极上氢离子放电;
(3)C电极是电解池阳极,阳极上氢氧根离子放电;
(4)根据金属和转移电子之间的关系式计算;
(5)根据溶液中的氢离子和氢氧根离子浓度是否变化确定.
(2)由(1)知,C是阳极,D是阴极,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,故答案为:阳;氧气;阴;氢气;
(3)C是阳极,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(4)设其摩尔质量为M,
电解时,B电极上的电极反应式为:X 2++2e-=X
2mol 1mol
0.004mol
| 0.128g |
| M |
M=
| 0.128g×2mol |
| 0.004mol×1mol |
故答案为:64g/mol;
(5)该电解池中,阳极上电极材料放电生成金属阳离子进入溶液,阴极上金属阳离子放电生成金属析出,进入的金属阳离子和析出的金属阳离子相等,所以溶液中的氢离子和氢氧根离子浓度都不变,则溶液的pH不变,故答案为:不变.

 阅读快车系列答案
阅读快车系列答案如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答:

(1)p为 极,A极发生了 反应(填反应类型)。
(2)C为 极,试管里收集到 ;D为 极,试管里收集到 。
(3)C极的电极方程式是 。
(4)在电解过程中,测得C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析上表,请说出得到以上实验数据可能的原因是 。
(5)当反应进行一段时间后,A、B电极附近溶液的pH (填“增大”、“减小”或“不变”)。
(6)当电路中通过0.004mol电子时,B电极上沉淀金属X的质量为0.128g,则此金属的摩尔质量为 。
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡。试回答:
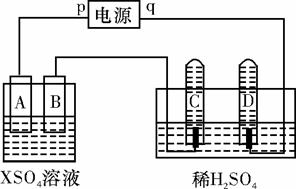
(1)p为 极,A极发生了 反应。
(2)C为 极,试管里收集到的气体是 。
(3)C极的电极反应式是 。
(4)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积 (cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体体积 (cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,造成阴、阳两极气体体积比变化的可能原因
是 。
(5)当反应进行一段时间后,A、B电极所在的电解池中溶液的pH (填“增大”、“减小”或“不变”)。
(6)当电路中通过0.004 mol电子时,B电极上沉积金属X为0.128 g,则此金属的摩尔质量为 。


