题目内容
7.下列物质能导电的是③⑤⑥⑦; 属于电解质的是①③⑧⑩;属于非电解质的是②④⑨ (填编号).①HCl气体、②NH3、③熔融的NaOH、④SO2、⑤Cu、⑥氨水⑦KNO3溶液、⑧液态醋酸、⑨蔗糖、⑩硫酸钡固体.
分析 水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质;物质导电有两种原因,一是金属类有自由移动的电子能够导电,二是能够产生自由离子的溶液能够导电.
解答 解:①HCl气体不能导电,溶于水能导电,属于电解质;
②NH3不能导电,溶于水因为生成了一水合氨,所以导电,本身不能电离,属于非电解质;
③熔融的NaOH能导电,属于电解质;
④SO2不能导电,溶于水能导电是因为生成了亚硫酸,亚硫酸导电,二氧化硫是非电解质;
⑤Cu能导电,是金属单质,既不是电解质也不是非的电解质;
⑥氨水能导电,属于混合物,既不是电解质也不是非电解质;
⑦KNO3溶液能导电,属于混合物,既不是电解质也不是非电解质;
⑧液态醋酸不能导电,溶于水能导电,属于电解质;
⑨蔗糖不能导电,属于非电解质;
⑩硫酸钡固体不能导电,熔融状态下能导电,属于电解质,
故答案为:③⑤⑥⑦;①③⑧⑩;②④⑨.
点评 本题较简单,主要考查电解质的定义,熟悉常见的酸、碱、盐都属于电解质来解答,注意导电,要从导电实质的角度去分析给定物质是否具备导电性能.

练习册系列答案
相关题目
17.现有以下物质,其中属于电解质的是( )
①NaCl溶液 ②干冰(固态的二氧化碳) ③冰醋酸(纯净的醋酸) ④铜 ⑤BaSO4固体 ⑥蔗糖 ⑦酒精⑧熔融的KNO3.
①NaCl溶液 ②干冰(固态的二氧化碳) ③冰醋酸(纯净的醋酸) ④铜 ⑤BaSO4固体 ⑥蔗糖 ⑦酒精⑧熔融的KNO3.
| A. | ①③⑤⑧ | B. | ②③④⑤⑥⑦ | C. | ③⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
18.某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4 (难溶盐)、Pb(MnO4)2(高锰酸铅强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1molX在该反应中应失去3.01×1023个电子.下列说法中不正确的是( )
| A. | 若有9.8gH2SO4参加反应,则转移电子的物质的量为1mol | |
| B. | 该反应的化学方程式为:5PbO2+2MnSO4+2H2SO4═Pb(MnO4)2+4PbSO4+2H2O | |
| C. | Pb(MnO4)2既是氧化产物又是还原产物 | |
| D. | X是MnSO4 |
15.辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe203、Si02及一些不溶性杂质.一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
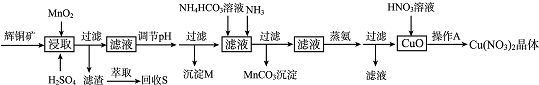
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol.L-1计算).
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnC03沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l
2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l
则由Cu2S与02加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(N03)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为Cu0,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(N03)2.

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol.L-1计算).
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnC03沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l
2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l
则由Cu2S与02加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(N03)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为Cu0,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(N03)2.
12.下列叙述正确的是( )
| A. | Na2CO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 0.1 mol•L-1NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | K2S溶液中:2c(K+)═c(H2S)+c(S2-)+c(HS-) | |
| D. | 相同浓度的CH3COOH和NaOH溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)═c(Na+) |
14.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8 NA | |
| B. | 12g NaHSO4固体中阴离子所带负电荷数为0.02 NA | |
| C. | 1 mol OD-含有的质子、中子、电子数均为9NA | |
| D. | 含4 NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中c(Na+)=2 mol•L-1 |