题目内容
一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol.
(1)所得溶液中Cl-的物质的量为多少?(写出必要的解答过程)
(2)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)是多少?(写出必要的解答过程)
(1)所得溶液中Cl-的物质的量为多少?(写出必要的解答过程)
(2)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)是多少?(写出必要的解答过程)
考点:有关混合物反应的计算
专题:
分析:(1)由于最终溶液中的溶质只有NaCl、NaClO,则n(Na+)=n(Cl-)+n(ClO-);
(2)由题意可知氯气过量,反应后所得混合物为HCl和Cl2,涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO),与H2反应的Cl2为n(Cl2)=
×[n(Cl-)-n(NaClO)],据此计算解答.
(2)由题意可知氯气过量,反应后所得混合物为HCl和Cl2,涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO),与H2反应的Cl2为n(Cl2)=
| 1 |
| 2 |
解答:
解:(1)由于最终溶液中的溶质只有NaCl、NaClO,则n(Na+)=n(Cl-)+n(ClO-),所以,n(Cl-)=0.1 L×3.00 mol/L-0.0500 mol=0.250 mol,故答案为:0.250mol;
(2)由题意可知氯气过量,反应后所得混合物为HCl和Cl2,
涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,
据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO)=0.05 mol,
与H2反应的Cl2为n(Cl2)=
×[n(Cl-)-n(NaClO)]=
×(0.25mol-0.05mol)=0.1mol=n(H2),
则所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=(0.1mol+0.05mol):0.1mol=3:2,故答案为:3:2.
(2)由题意可知氯气过量,反应后所得混合物为HCl和Cl2,
涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,
据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO)=0.05 mol,
与H2反应的Cl2为n(Cl2)=
| 1 |
| 2 |
| 1 |
| 2 |
则所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=(0.1mol+0.05mol):0.1mol=3:2,故答案为:3:2.
点评:本题考查化学方程式计算、混合物计算,侧重于学生计算能力和分析能力的考查,注意判断反应的程度以及相关方程式的书写,注意利用守恒思想解答.

练习册系列答案
相关题目
下列各组试剂在溶液中的反应,当两种试剂的量发生变化时,不能用同一离子反应方程式表示的是( )
| A、氯化镁、氢氧化钠 |
| B、硫酸钠、氢氧化钡 |
| C、氯化铝、氨水 |
| D、溴化亚铁、氯水 |
下列物质中属于天然高分子化合物的是( )
| A、淀粉 | B、葡萄糖 |
| C、纤维素 | D、乙酸 |
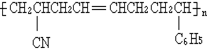 工程塑料ABS树脂(结构简式如图,式中-C6H5是苯基),合成它的单体有( )
工程塑料ABS树脂(结构简式如图,式中-C6H5是苯基),合成它的单体有( )①CH3C(CN)=CH2
②CH2=CH-CN
③CH≡CH
④CH2=CH-CH=CH2
⑤C H2=CH-C6H5
⑥CH2=CH-CH=CHC6H5.
| A、①③⑥ | B、②③⑤ |
| C、②④⑤ | D、②③⑥ |
在反应:11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4 中15mol CuSO4 氧化的P原子的物质的量为( )
| A、3mol |
| B、11 mol |
| C、6 mol |
| D、5 mol |
A、B、C、D、E是同一周期的五种主族元素,A与B的最高价氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物的还原性为D>C;五种元素的原子得失电子后所形成的简单离子中E的离子半径最小,则它们的原子序数由小到大的顺序为( )
| A、BAEDC |
| B、CDBAE |
| C、ABCDE |
| D、ECDBA |
