题目内容
15.9.03×1023个H2O的物质的量为1.5mol,所含H的物质的量为3mol,所含氧原子的物质的量为1.5mol.分析 选根据n=$\frac{N}{{N}_{A}}$计算出9.03×1023个H2O的物质的量,然后结合水分子的组成分别计算出含有H、O原子的物质的量.
解答 解:9.03×1023个H2O的物质的量为:n(H2O)=$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}}$mol=1.5mol,1.5mol H2O中含有H的物质的量为:n(H)=2n(H2O)=1.5mol×2=3mol,含有O原子的物质的量为:n(H)=n(H2O)=1.5mol,
故答案为:1.5mol;3mol;1.5mol.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数的关系为解答关键,注意掌握常见物质分子组成与含有原子的物质的量关系,试题培养了学生的化学计算能力.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
5.铝和铝合金具有许多优良的性质,用途广泛.下列用途主要是体现铝的物理性质的是( )
①制导线②盛浓硫酸的容器③包装用的铝箔④工业上冶炼金属钒、铬、锰等⑤工业制做热交换器⑥做合金用作飞机制造业材料.
①制导线②盛浓硫酸的容器③包装用的铝箔④工业上冶炼金属钒、铬、锰等⑤工业制做热交换器⑥做合金用作飞机制造业材料.
| A. | ①③⑤⑥ | B. | ②③④⑥ | C. | ①②③④⑤ | D. | ①③④⑥ |
6.对于反应A(g)+3B(g)?2C(g)+2D(g),下列四个数据是在不同条件下测出的该反应的化学反应速率,其中最快的是( )
| A. | v(D)=0.4mol/(L•S) | B. | v(C)=30mol/(L•min) | C. | v (B)=30mol/(L•min) | D. | v(A)=0.15mol/(L•S) |
10.某同学通过向FeI2溶液中滴加某些试剂的方法证明还原性:I->Fe2+>Br-,下列试剂肯定不需要使用的是( )
| A. | 淀粉 | B. | 溴水 | C. | 氯水 | D. | KSCN |
4.分离下列混合物不能用过滤的方法的是( )
| A. | 硫酸铜溶液和氢氧化钠溶液反应后的生成物 | |
| B. | 铁粉和铜粉跟稀硫酸反应后的生成物 | |
| C. | 氢氧化钠和盐酸反应后的生成物 | |
| D. | 用氯酸钾和二氧化锰的混合物加热制氧气后的剩余物质 |
11.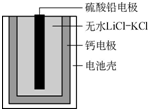 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )| A. | 该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb | |
| B. | 放电过程中,Li+向正极移动 | |
| C. | 每转移0.1mol电子,理论上生成20.7gPb | |
| D. | 常温下电解质是不导电的固体,电池不工作 |
