题目内容
13.下列叙述中正确的是( )| A. | 1 mol氢的质量是1 g | B. | 1 mol CO的质量为28 g•mol-1 | ||
| C. | 阿伏加德罗常数等于6.02×1023 | D. | 3.01×1023个SO2分子约是0.5 mol |
分析 结合m=nM、n=$\frac{N}{{N}_{A}}$及阿伏加德罗常数计算.
解答 解:A.1 molH的质量是1mol×1g/mol=1 g,物质的量只描述微观粒子,不能表述为1 mol氢,故A错误;
B.1 mol CO的质量为1mol×28 g•mol-1=28g,故B错误;
C.阿伏加德罗常数等于NA,约为6.02×1023,故C错误;
D.3.01×1023个SO2分子约是$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5 mol,故D正确;
故选D.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、微粒个数的关系为解答的关键,侧重分析与计算能力的考查,注意选项AC均为解答的易错点,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
15.如表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃).
回答下列问题:
(1)由如表分析,若①CH3COOH ②HCO3-③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为①④③②(须填编号).
(2)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)=c(NH4+)(填“>”、“=”或“<”).
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是CD.
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
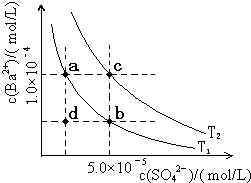 (5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
①T1< T2(填>、=、<);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是ABC.
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点.
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3•H2O | NH3•H2O?NH4++OH- | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2?Mg2++2OH- | 5.6×10-12 |
(1)由如表分析,若①CH3COOH ②HCO3-③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为①④③②(须填编号).
(2)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)=c(NH4+)(填“>”、“=”或“<”).
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是CD.
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
 (5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:①T1< T2(填>、=、<);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是ABC.
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点.
8.表为元素周期表的一部分:
请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图 .
.
(2)②、③、⑤的离子半径由大到小的顺序为S2->O2->Na+.
(3)元素④和⑥形成的化合物的电子式: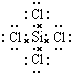 .
.
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
(1)画出元素②的离子结构示意图
 .
.(2)②、③、⑤的离子半径由大到小的顺序为S2->O2->Na+.
(3)元素④和⑥形成的化合物的电子式:
 .
.
18.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 1.8g18O2分子与1.8g18O3分子中含有的中子数不同 | |
| B. | 7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA | |
| C. | 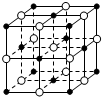 23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元 | |
| D. | 含16 g氧原子的二氧化硅晶体中含有的δ键数目为NA |
5.a、b、c、d是HCl、AlCl3、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如表.由此推出a、b、c、d依次为( )
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | ↓ | ↓↑ | ↓ | ↓ | ↑ |
| A. | AlCl3、HCl、AgNO3、Na2CO3 | B. | AgNO3、HCl、Na2CO3、AlCl3 | ||
| C. | Na2CO3、AlCl3、HCl、AgNO3 | D. | AgNO3、HCl、AlCl3、Na2CO3 |
2.下列有关物质用途的说法中,正确的是( )
| A. | 工业上利用氨气制硝酸属于人工固氮 | |
| B. | 明矾能够消毒杀菌是利用了胶体的吸附性 | |
| C. | 常温下,运输浓H2SO4、浓HNO3时可用铝制或铁制槽车 | |
| D. | 硅可用于制造光导纤维 |
3.化学与材料、生活和环境密切相关.下列有关说法中正确的是( )
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 酸性高锰酸钾溶液应装在酸式滴定管中,原因是酸性高锰酸钾能氧化橡胶 | |
| C. | 植物油和裂化汽油都能使溴水褪色,原理是不同的 | |
| D. | 明矾能够用于净水,是因为明矾的溶液是酸性的 |
 ,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.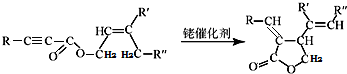
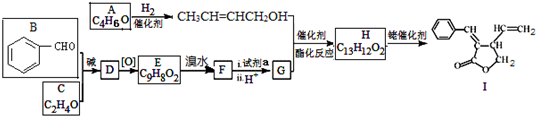
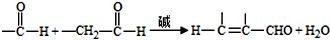
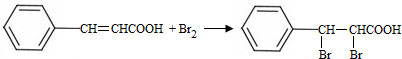 ;试剂a 是NaOH、醇溶液.
;试剂a 是NaOH、醇溶液.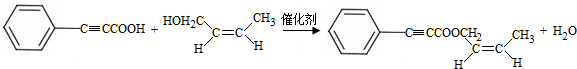 .
.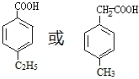 (写出一种即可).
(写出一种即可). 和CH3CHO为原料合成
和CH3CHO为原料合成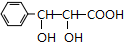 的合成路线流程图:
的合成路线流程图: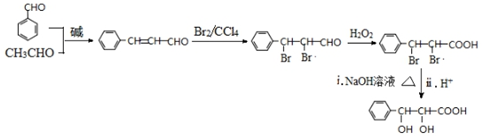 .(其它试剂任选,合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
.(其它试剂任选,合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)