题目内容
20.下列说法或表示方法正确的是( )| A. | 甲烷的标准燃烧热为-890.3 kJ•molˉ1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•molˉ1 | |
| B. | 由C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•molˉ1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OHˉ(aq)=H2O(l)△H=-57.3 kJ•molˉ1,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 一定条件下,某密闭容器中充入2 mol SO2(g)和1 mol O2(g),达到平衡后,放出Q kJ热量,则该条件下的热化学方程式为:2SO2(g)+O2(g)?2SO3(g )△H=-Q kJ•molˉ1 |
分析 A、燃烧热指的是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,注意生成的水应为液态;
B、物质具有的能量越低越稳定;
C、醋酸电离过程吸热;
D、2 mol SO2(g)和1 mol O2(g)反应达到平衡时生成SO3(g )的物质的量小于2mol.
解答 解:A、甲烷的标准燃烧热为-890.3 kJ•molˉ1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•molˉ1,故A错误;
B、由C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•molˉ1可知,石墨的能量较低,石墨比金刚石稳定,故B错误;
C、由于醋酸电离过程吸热,因此1 mol CH3COOH与含1 mol NaOH的溶液混合生成1mol水时放出的热量小于57.3 kJ,故C正确;
D、2 mol SO2(g)和1 mol O2(g)反应达到平衡时生成SO3(g )的物质的量小于2mol,则该条件下的热化学方程式为:2SO2(g)+O2(g)?2SO3(g )△H<-Q kJ•molˉ1,故D错误;
故选C.
点评 本题考查了化学反应中的能量变化,侧重于热化学方程式、燃烧热和中和热的理解和应用,难度不大,注意可逆反应的特点.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
10.玻璃棒是化学实验中常用的仪器,通常用于搅拌、引流等.下列有关实验过程中,不需要使用玻璃棒进行操作的是( )
| A. | 用pH试纸测定Na2CO3溶液的pH | |
| B. | 从食盐水中提取NaCl | |
| C. | 用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2 | |
| D. | 配制100ml 0.1000mol/L的NaCl溶液 |
11.如表实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热.冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 测定中和热 | 取0.5mol.L-1的盐酸与0.55mol.L-1的NaOH溶液各50ml混合用量热器测定温度变化. |
| D | 验证浓度对化学平衡的影响 | 向0.1mol.L-1的重铬酸钾溶液中滴几滴浓硫酸观察颜色,再滴几滴NaOH溶液观察颜色变化. |
| A. | A | B. | B | C. | C | D. | D |
8.在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)?3C(g)+D(s),达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是( )
| A. | 1mol A+0.5mol B+1.5mol C+0.1mol D | |
| B. | 3mol C+0.5mol D | |
| C. | 2mol A+1mol B+1molD | |
| D. | 0.5mol A+0.25mol B+2.25mol C |
15.下列有机物中能与NaOH溶液发生反应的是( )
①甲苯 ②乙酸 ③乙醇 ④乙酸乙酯 ⑤油脂.
①甲苯 ②乙酸 ③乙醇 ④乙酸乙酯 ⑤油脂.
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ②④⑤ |
12.下列说法正确的是( )
| A. | 棉花和蚕丝的主要成分都是纤维素 | |
| B. | 淀粉和蛋白质在一定条件下都能发生水解反应生成葡萄糖 | |
| C. | 食用植物油的主要成分是不饱和高级脂肪酸甘油酯,属于高分子化合物 | |
| D. | 由青蒿素(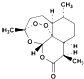 )合成双氢青蒿素( )合成双氢青蒿素(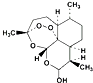 )的反应属于加成反应 )的反应属于加成反应 |
10.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系正确的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊,继续通入CO2至过量,溶液变澄清 | BaCl2溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色退去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,无明显变化 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
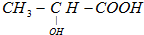 ),乳酸在微生物作用下分解为CO2和H2O.
),乳酸在微生物作用下分解为CO2和H2O.


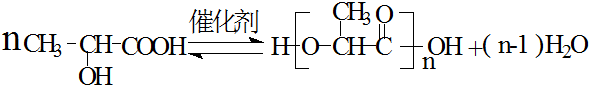 .
.