题目内容
5.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层电子数是次外层的2倍,Y是非金属性最强的元素,在周期表中Z位于IIA,Y与W属于同一主族.下列说法正确的是( )| A. | 简单气态氢化物的热稳定性:Y<W | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | Z和W的简单离子具有相同的电子层结构 | |
| D. | 化合物ZX2中既含有离子键,又含有共价键 |
分析 短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层电子数是次外层的2倍,应为C元素,Y是非金属性最强的元素,应为F元素,在周期表中Z位于IIA,应为Mg元素,Y与W属于同一主族,则W为Cl元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知X为C元素、Y为F元素、Z为Mg元素,W为Cl元素.
A.非金属性F>Cl,元素的非金属性越强,对应的氢化物越稳定,故A错误;
B.同周期元素从左到右原子半径逐渐减小,则应为Mg>Cl>C>F,故B错误;
C.Z为Mg元素,对应离子核外有2个电子层,W为Cl元素,对应离子核外有3个电子层,故C错误;
D.化合物MgC2中既含有离子键,又含有共价键,可水解生成氢氧化镁和乙炔,故D正确.
故选D.
点评 本题考查结构性质位置关系应用,为高频考点,正确推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
20.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.关于${\;}_{116}^{203}$Lv的叙述错误的是( )
| A. | 原子序数116 | B. | 中子数177 | C. | 核外电子数116 | D. | 质子数177 |
16.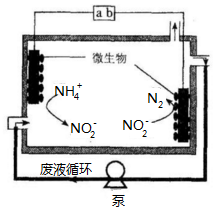 微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
 微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )| A. | a为电源的负极 | |
| B. | 右侧电极反应式为:2NO2-+6e-+4 H+=N2↑+4OH- | |
| C. | 电池工作一段时间后,溶液中NO2-的浓度不变 | |
| D. | 每通过3mol电子,最多处理0.5mol NH4+ |
13.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是( )
| A. | 偏二甲肼(C2H8N2)的摩尔质量为60g | |
| B. | 火箭发射时,偏二甲肼(C2H8N2)燃烧生成CO2、N2、H2O | |
| C. | 偏二甲肼(C2H8N2)中所有原子最外层都达到8个电子 | |
| D. | 从能量变化看,主要是化学能转变为热能和动能,它是一种能量很高的烃 |
20.乙烯的相关转化关系如图,下列说法正确的是( )
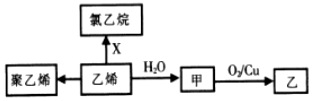

| A. | 1mol聚乙烯含有的原子数目为6NA | B. | CH3OCH3与甲互为同分异构体 | ||
| C. | X为C12 | D. | 甲→乙反应类型为取代反应 |
10.铅蓄电池是常见的二次电池,某学生用铅蓄电池进行下列实验,如图所示.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列判断错误的是( )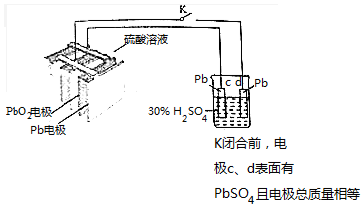

| A. | 铅蓄电池的结构中栅状极板应交替排列 | |
| B. | 铅蓄电池放电时Pb电极的电极反应为:Pb-2e-═Pb2+ | |
| C. | K闭合时,烧杯中SO42-向c电极迁移 | |
| D. | K闭合后,若c、d电极的质量相差3.2g,则转移的电子可能为0.2mol |
17.将①中溶液滴入②中,预测的现象与实际相符的是( )
| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D. | 亚硫酸钠溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
14.铅蓄电池有广泛的应用,由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如图1:

査阅资料:①PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g•L-1):
(1)步骤I中FeCl3溶液与PbS反应生成PbCl2和S的化学方程式为PbS+2FeCl3=PbCl2+2FeCl2+S;
加入盐酸控制pH小于1.0的原因是抑制Fe3+的水解.
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是加快浸泡速率、增大PbCl2在氯化钠溶液中的溶解度.
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出(请用平衡移动原理解释).
(4)步骤IV需用溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制,需用到的玻璃仪器有ABE(填相应的字母).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3,NO2-转化为无毒物质),其装置如图2所示.
①左池中Cr2O72-转化为Cr3+的离子方程式是6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
②当阴极区消耗2mol NO2-时,右池减少的H+的物质的量为2 mol.

査阅资料:①PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g•L-1):
| NaCl浓度(g.L-1) 温度(℃) | 20 | 40 | 60 | 100 | 180 | 260 | 300 |
| 13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
| 50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
| 100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
加入盐酸控制pH小于1.0的原因是抑制Fe3+的水解.
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是加快浸泡速率、增大PbCl2在氯化钠溶液中的溶解度.
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是冰水浴使反应PbCl2(s)+2Cl-(aq)?PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出(请用平衡移动原理解释).
(4)步骤IV需用溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制,需用到的玻璃仪器有ABE(填相应的字母).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3,NO2-转化为无毒物质),其装置如图2所示.
①左池中Cr2O72-转化为Cr3+的离子方程式是6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
②当阴极区消耗2mol NO2-时,右池减少的H+的物质的量为2 mol.
15.化学与生产、生活、社会密切相关,下列有关说法不正确的是( )
| A. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| B. | 为防止食品氧化变质,常在食品包装袋中放入生石灰 | |
| C. | 用加热灼烧的方法可以区分羊毛毛线和腈纶毛线 | |
| D. | 加快开发髙效洁净能源转换技术,缓解能源危机 |