题目内容
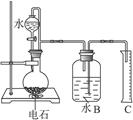
(16分)下图中的实验装置可用于制取乙炔。请填空:

(1)图中,A管的作用是 。
制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。

(1)图中,A管的作用是 。
制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。
(1)调节水面高度以控制反应的发生与停止;CaC2+2H2O →C2H2↑+ Ca(OH)2 (2)酸性KMnO4溶液褪色;氧化(3)溴的CCl4溶液褪色;加成
(4)检验纯度;火焰明亮并伴有浓烈黑烟、放出热量
(4)检验纯度;火焰明亮并伴有浓烈黑烟、放出热量
(1)因为电石与水很剧烈,反应不易控制,所以通过调节水面高度以控制反应的发生与停止,方程式为CaC2+2H2O →C2H2↑+ Ca(OH)2。
(2)乙炔中含有碳碳三键,容易被氧化,所以乙炔可以使酸性高锰酸钾溶液褪色。
(3)同样因为乙炔中含有碳碳三键,容易发生加成反应,所以乙炔可以使溴的CCl4溶液褪色。
(4)乙炔实验可燃性气体,点燃前需要检验其纯度。防止燃烧时爆炸。乙炔中含碳量很高,燃烧时火焰明亮并伴有浓烈黑烟。
(2)乙炔中含有碳碳三键,容易被氧化,所以乙炔可以使酸性高锰酸钾溶液褪色。
(3)同样因为乙炔中含有碳碳三键,容易发生加成反应,所以乙炔可以使溴的CCl4溶液褪色。
(4)乙炔实验可燃性气体,点燃前需要检验其纯度。防止燃烧时爆炸。乙炔中含碳量很高,燃烧时火焰明亮并伴有浓烈黑烟。

练习册系列答案
相关题目