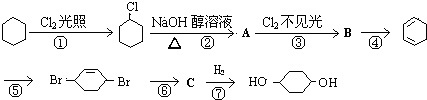
题目内容
实验室用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
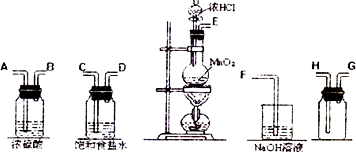
(1)连接上述仪器的正确顺序是(填各接口处的字母):
接 , 接 , 接 , 接 .
(2)在装置中①饱和食盐水起的作用是 .②浓硫酸起的作用是 .
(3)写出气体发生装置中进行的反应的化学方程式: .
(4)实验室制备氯气的装置与下列哪种气体的装置相类似 .
A、O2 B、CO2 C、HCl D、NH3
(5)多余的氯气用 吸收.
(6)8.7g二氧化锰和37%浓盐酸100mL(密度为1.19g/mL)充分反应,生成的氯气在标准状况下的体积为多少毫升?(要求书写计算过程)

(1)连接上述仪器的正确顺序是(填各接口处的字母):
(2)在装置中①饱和食盐水起的作用是
(3)写出气体发生装置中进行的反应的化学方程式:
(4)实验室制备氯气的装置与下列哪种气体的装置相类似
A、O2 B、CO2 C、HCl D、NH3
(5)多余的氯气用
(6)8.7g二氧化锰和37%浓盐酸100mL(密度为1.19g/mL)充分反应,生成的氯气在标准状况下的体积为多少毫升?(要求书写计算过程)
考点:氯气的实验室制法
专题:实验题
分析:二氧化锰跟浓盐酸反应制备干燥纯净的氯气,气体的制备一般经过气体的发生装置,净化、除杂、干燥装置,再经收集装置,尾气处理装置,根据这个思路结合所学知识来解题.
(1)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(2)根据氯气、氯化氢的性质分析;根据浓硫酸的性质分析;
(3)根据氯气的制备反应书写化学方程式;
(4)依据实验制备气体所用原料的物质状态和反应条件选择装置,氯气制备是固体和液体加热反应制气体;
(5)根据氯气的化学性质进行判断;
(6)依据化学方程式的过量计算判断,以全部反应的物质计算生成的氯气;
(1)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(2)根据氯气、氯化氢的性质分析;根据浓硫酸的性质分析;
(3)根据氯气的制备反应书写化学方程式;
(4)依据实验制备气体所用原料的物质状态和反应条件选择装置,氯气制备是固体和液体加热反应制气体;
(5)根据氯气的化学性质进行判断;
(6)依据化学方程式的过量计算判断,以全部反应的物质计算生成的氯气;
解答:
解:(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,段导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;收集装置中,因为氯气的浓度大于空气的,所以长导管进气短导管出气.
故答案为:E-C,D-A,B-H,G-F;
(2)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度;浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气.
故答案为:除去挥发出的HCl气体,抑制C12在水中的溶解;吸收水蒸气,干燥Cl2;
(3)实验室利用装置制备氯气是利用 固体二氧化锰和液体浓盐酸加热反应制备,反应的化学方程式为:MnO2+4HCl
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl
MnCl2+Cl2↑+2H2O;
(4)实验制备气体所用原料的物质状态和反应条件选择装置,氯气制备是固体+液体
气体,是装置选择的原则;
A、氧气是固体和固体加热制气体;故A不符合;
B、二氧化碳是固体和液体不加热制气体,故B不符合;
C、氯化氢是氯化钠固体和浓硫酸液体加热制气体,符合氯气制备装置,故C符合;
D、氨气是固体和固体加热制气体,故D不符合;
故选C.
(5)要吸收氯气,氯气的溶解度较小,必须使氯气反应化学反应,选项中能够与氯气反应的有氢氧化钠溶液;
故答案为:氢氧化钠溶液;
(6)8.7g二氧化锰和37%浓盐酸100mL(密度为1.19g/mL)充分反应,二氧化锰物质的量为0.1mol,浓盐酸中氯化氢物质的量=
=1.2mol;盐酸中氯化氢过量,MnO2+4HCl
MnCl2+Cl2↑+2H2O;依据二氧化锰计算氯气物质的量为0.1mol,标准状况下,氯气的体积为2.24L即2240ml;
故答案为:2240ml;
故答案为:E-C,D-A,B-H,G-F;
(2)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度;浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气.
故答案为:除去挥发出的HCl气体,抑制C12在水中的溶解;吸收水蒸气,干燥Cl2;
(3)实验室利用装置制备氯气是利用 固体二氧化锰和液体浓盐酸加热反应制备,反应的化学方程式为:MnO2+4HCl
| ||
故答案为:MnO2+4HCl
| ||
(4)实验制备气体所用原料的物质状态和反应条件选择装置,氯气制备是固体+液体
| △ |
A、氧气是固体和固体加热制气体;故A不符合;
B、二氧化碳是固体和液体不加热制气体,故B不符合;
C、氯化氢是氯化钠固体和浓硫酸液体加热制气体,符合氯气制备装置,故C符合;
D、氨气是固体和固体加热制气体,故D不符合;
故选C.
(5)要吸收氯气,氯气的溶解度较小,必须使氯气反应化学反应,选项中能够与氯气反应的有氢氧化钠溶液;
故答案为:氢氧化钠溶液;
(6)8.7g二氧化锰和37%浓盐酸100mL(密度为1.19g/mL)充分反应,二氧化锰物质的量为0.1mol,浓盐酸中氯化氢物质的量=
| 100ml×1.19g/ml×37% |
| 36.5g/mol |
| ||
故答案为:2240ml;
点评:本题考查了实验装置仪器的连接顺序是实验发生装置→除杂装置→收集装置→尾气处理装置;实验室制备气体的装置选择,实验除杂的方法选择和试剂作用,浓盐酸和二氧化锰能反应过量判断和计算.

练习册系列答案
相关题目
取物质的量浓度为0.05mol?L-1的金属氯化物(RClx) 溶液20mL,使之恰好与20mL 0.15mol?L-1的AgNO3溶液完全反应.则该氯化物的化学式为( )
| A、RCl |
| B、RCl2 |
| C、RCl3 |
| D、RCl4 |
“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用.下列化学反应,不符合绿色化学概念的是( )
| A、硫酸厂尾气的处理:SO2+2NH3+H2O═(NH4)2SO3 |
| B、硝酸工业尾气的处理:NO2+NO+2NaOH═2NaNO2+H2O |
| C、制CuSO4:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O |
| D、制CuSO4:2Cu+O2═2CuO,CuO+H2SO4═CuSO4+H2O |