题目内容
现有①Ar②金刚石 ③NH4Cl ④SiO2⑤干冰 ⑥K2S ⑦N2七种物质,按下列要求回答:(填序号)
(1)属于离子化合物的是 .
(2)⑤的结构式是 ,⑦的电子式是 .
(1)属于离子化合物的是
(2)⑤的结构式是
考点:离子化合物的结构特征与性质,电子式
专题:化学用语专题,化学键与晶体结构
分析:(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
(2)二氧化碳分子中每个氧原子和碳原子形成 两对共用电子对,氮气分子中两个N原子形成三对共用电子对.
(2)二氧化碳分子中每个氧原子和碳原子形成 两对共用电子对,氮气分子中两个N原子形成三对共用电子对.
解答:
解:(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,氯化铵是由铵根离子和氯离子构成的离子化合物,硫化钾是由钾离子和硫离子构成的离子化合物,所以属于离子化合物的是③⑥,故答案为:③⑥;
(2)二氧化碳分子中每个氧原子和碳原子形成 两对共用电子对,二氧化碳的结构式为O=C=O,氮气分子中两个N原子形成三对共用电子对,氮气分子的电子式为 ,
,
故答案为:O=C=O; .
.
(2)二氧化碳分子中每个氧原子和碳原子形成 两对共用电子对,二氧化碳的结构式为O=C=O,氮气分子中两个N原子形成三对共用电子对,氮气分子的电子式为
 ,
,故答案为:O=C=O;
 .
.
点评:本题考查了离子化合物的判断、结构式和电子式的书写等知识点,根据物质的构成微粒确定化合物类型,再结合电子式及结构式书写特点书写,题目难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
下列实验方案能顺利达到实验目的是( )
A、 排空气法收集NO |
B、 乙醇萃取碘水中碘 |
C、 过滤 |
D、 量取9.3mLH2O |
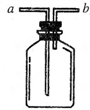 (1)现有人图所示装置,为实现下列实验目的,其中应以a端作为入口的是
(1)现有人图所示装置,为实现下列实验目的,其中应以a端作为入口的是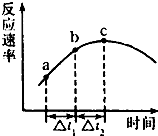 NO、NO2、SO2、CO等均为大气污染物,研究这些气体的吸收和处理意义重大.请回答下列问题:
NO、NO2、SO2、CO等均为大气污染物,研究这些气体的吸收和处理意义重大.请回答下列问题: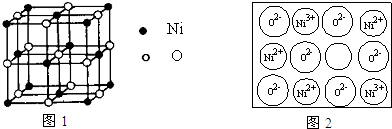
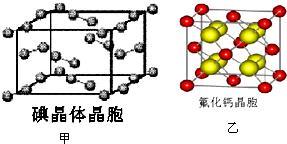 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6