题目内容
下列叙述中正确的是(设NA为阿佛加德罗常数)( )
| A.标准状况下,22.4L苯所含的分子数为NA |
| B.0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| C.2mol SO2和1mol O2在密闭容器中加热(V205催化)充分反应后,容器内分子总数大于2NA |
| D.一定温度下,1L、0.50mol?L NH4Cl溶液与2L、0.25mo1?L-1 NH4Cl溶液含NH4+物质的量相同 |
A、标准状况下,苯是液体,不能使用气体摩尔体积22.4L/mol,故A错误;
B、由反应Fe+3Cl2═FeCl3可知,0.1mol Fe在0.1mol C12中充分燃烧,氯气不足,氯元素化合价由0价降低为-1价,转移电子数为0.1mol×2×NAmol-1=0.2NA,故B错误;
C、由反应 2SO2+O2
SO3可知,若2mol SO2和1mol O2完全反应,恰好生成2molSO3,容器内分子数为2NA,由于二氧化硫与氧气反应为可逆反应,反应存在限度,反应物不能完全反应,所以容器内气体的物质的量大于2mol,所以容器内分子数大于2NA,故C正确;
D、若溶液中铵根离子的水解程度相同,0.50mol?L NH4Cl溶液中NH4+离子浓度是0.25mo1?L-1 NH4Cl溶液中NH4+浓度2倍,但溶液浓度越小水解程度越大,所以0.25mo1?L-1 NH4Cl溶液中NH4+水解程度更大,所以0.50mol?L NH4Cl溶液中NH4+离子浓度大于0.25mo1?L-1 NH4Cl溶液中NH4+浓度2倍,根据n=cV可知,lL0.50mol?L NH4Cl溶液中NH4+的大于与2L0.25mo1?L-1 NH4Cl溶液含NH4+物质的量,故D错误.
故选:C.
B、由反应Fe+3Cl2═FeCl3可知,0.1mol Fe在0.1mol C12中充分燃烧,氯气不足,氯元素化合价由0价降低为-1价,转移电子数为0.1mol×2×NAmol-1=0.2NA,故B错误;
C、由反应 2SO2+O2
| 催化剂 |
D、若溶液中铵根离子的水解程度相同,0.50mol?L NH4Cl溶液中NH4+离子浓度是0.25mo1?L-1 NH4Cl溶液中NH4+浓度2倍,但溶液浓度越小水解程度越大,所以0.25mo1?L-1 NH4Cl溶液中NH4+水解程度更大,所以0.50mol?L NH4Cl溶液中NH4+离子浓度大于0.25mo1?L-1 NH4Cl溶液中NH4+浓度2倍,根据n=cV可知,lL0.50mol?L NH4Cl溶液中NH4+的大于与2L0.25mo1?L-1 NH4Cl溶液含NH4+物质的量,故D错误.
故选:C.

练习册系列答案
相关题目
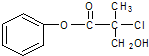 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


