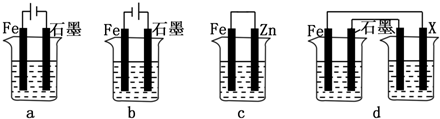
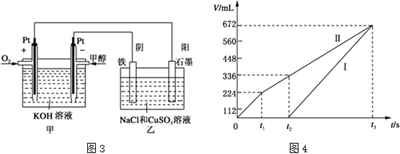
题目内容
6.关于原子序数为53的元素,以下说法正确的是( )| A. | 位于第六周期 | B. | 是金属元素 | ||
| C. | 最外电子层含有6个电子 | D. | 属于卤族元素 |
分析 根据原子序数=核内质子数=核外电子数,可知其质子数;金属元素:带金字旁(除汞),则可知碘元素为非金属元素;熟练掌握元素周期表中各元素符号周围内容的含义.
解答 解:A、碘在元素周期表中位于第五周期,故A错误;
B、金属元素:带金字旁(除汞),碘为非金属元素,故B错误;
C、53号元素碘是卤素元素,最外层7个电子,故C错误;
D、53最外层7个电子,所以是卤族元素,故D正确;
故选D.
点评 本题考查元素周期表的特点及其应用,会识别和应用原子结构示意图,熟练掌握元素周期表中各元素符号周围内容的含义.

练习册系列答案
相关题目
17. A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )
 A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是( )| A. | 若X为KOH溶液,则A可能为Al | |
| B. | 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2 | |
| C. | 若X为O2,则A可为非金属单质硫 | |
| D. | 若X为Fe,则C可能为Fe(NO3)2溶液 |
14.下列物质在水溶液中的电离方程式书写正确的是 ( )
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++HSO4- | ||
| C. | Al2 (SO4)3═Al 3++SO42- | D. | Na2SO4═2Na++SO42 |
1.某一元醇A和一元羧酸B形成的酯的式量为212,分子内碳原子数是氢、氧原子数之和.该酯不能使溴的四氯化碳溶液褪色,又知A可氧化得B.则下列叙述中,正确的是( )
| A. | A的式量比B大14 | |
| B. | B的式量比A大16 | |
| C. | 该酯中一定不含双键等不饱和键 | |
| D. | 酯、A、B三种物质的分子中都含一种相同的式量大于45的原子团 |
11.下列说法正确的是( )
| A. | 放热反应在任意条件下都能自发进行 | |
| B. | 已知热化学方程式2A(g)+B(g)?2C (g)△H=-QkJ/mol (Q>0)将2molA(g)和1molB(g)置于一密闭容器中充分反应后放出QkJ的热量 | |
| C. | 1mol/L的盐酸与1mol/L的氨水、11mol/L的NaOH溶液等体积混合,充分反应,后者比前者放出的热量多 | |
| D. | BaCl2溶液中加过量H2SO4,溶液中一定不存在Ba2+ |
18.实验室鉴别庚烷、1-庚烯和甲苯,所采用的试剂可以是下列中的( )
| A. | 溴水石蕊溶液 | B. | 氢氧化钠溶液和溴水 | ||
| C. | 溴水和高锰酸钾酸性溶液 | D. | 高锰酸钾溶液 |
15.据报道,继通过食盐补碘在全国范围内基本实现消除碘缺乏病目标之后,我国又将启动一项涉及千家万户营MgSO4养健康问题的“补铁工程”.卫生部已批准以酱油为食物载体,逐步开展补铁工程.这里的碘、铁指的是( )
| A. | 元素 | B. | 原子 | C. | 分子 | D. | 单质 |
16.已知(CH3)2C=CH2,可表示为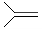 ,脱落酸(如图)可用作植物生长抑制剂,下
,脱落酸(如图)可用作植物生长抑制剂,下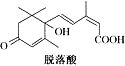 列对该物质的叙述正确的是( )
列对该物质的叙述正确的是( )
 ,脱落酸(如图)可用作植物生长抑制剂,下
,脱落酸(如图)可用作植物生长抑制剂,下 列对该物质的叙述正确的是( )
列对该物质的叙述正确的是( )| A. | 其分子式为C15H22O4 | |
| B. | 其属于芳香族化合物 | |
| C. | 能与氢氧化钠溶液反应,但不能与碳酸氢钠溶液反应 | |
| D. | 该物质在一定条件下可发生自身取代反应生成含七元环的物质. |
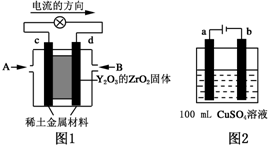 (1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).
(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e--→2O2-).