题目内容
化学平衡原理在工农业生产中发挥着重要的指导作用.
(1)反应C(s)+CO2(g)?2CO(g)平衡常数K的表达式为 ;
已知C(s)+H2O(g)?CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)?CO(g)+H2O(g)的平衡常数为K2,则K与K1、K2二者的关系为 .
(2)已知某温度下,反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=19,在该温度下某体积固定的密闭容器中充入C(SO2)=1mol?L-1,C(O2)=1mol?L-1,当反应进行到一定程度时测得SO2的物质的量分数为12.5%,此时该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”)方向进行.
(3)对于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H=akJ?mol-1;若a+b>c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a 0(填“>”或“<”)
(1)反应C(s)+CO2(g)?2CO(g)平衡常数K的表达式为
已知C(s)+H2O(g)?CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)?CO(g)+H2O(g)的平衡常数为K2,则K与K1、K2二者的关系为
(2)已知某温度下,反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=19,在该温度下某体积固定的密闭容器中充入C(SO2)=1mol?L-1,C(O2)=1mol?L-1,当反应进行到一定程度时测得SO2的物质的量分数为12.5%,此时该反应
(3)对于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H=akJ?mol-1;若a+b>c+d,增大压强平衡向
考点:用化学平衡常数进行计算,化学平衡常数的含义,化学平衡的影响因素
专题:
分析:(1)化学平衡常数,是指在一定温度下,达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
根据各反应的平衡常数,判断K与K1、K2的关系;
(2)根据三段式计算出SO2转化率为80%时,各组分的浓度,计算浓度商Qc,根据浓度商与平衡常数的关系,判断是否处于平衡状态或平衡的移动方向,Qc=k,处于平衡状态,Qc>k反应向逆反应进行,Qc<k反应向正反应进行;
(3)增大压强平衡向气体体积减小的方向移动;
升高温度,平衡向逆反应方向移动,说明正反应是放热反应.
根据各反应的平衡常数,判断K与K1、K2的关系;
(2)根据三段式计算出SO2转化率为80%时,各组分的浓度,计算浓度商Qc,根据浓度商与平衡常数的关系,判断是否处于平衡状态或平衡的移动方向,Qc=k,处于平衡状态,Qc>k反应向逆反应进行,Qc<k反应向正反应进行;
(3)增大压强平衡向气体体积减小的方向移动;
升高温度,平衡向逆反应方向移动,说明正反应是放热反应.
解答:
解:(1)反应C(s)+CO2(g)?2CO(g)的平衡常数K=
;
反应C(s)+H2O(g)?CO(g)+H2(g)的平衡常数为K1=
,反应H2(g)+CO2(g)?CO(g)+H2O(g)的平衡常数为K2=
,由平衡常数
×
=
,即K=K1×K2;
故答案为:
;K=K1×K2;
(2)该温度下SO2转化率为80%时,△c(SO2)=1mol?L-1×80%=0.8mol/L,则:
2SO2(g)+O2 (g)?2SO3(g),
开始(mol/L):1 1 0
变化(mol/L):0.8 0.4 0.8
SO2转化率为80%时(mol/L):0.2 0.6 0.8
所以浓度商Qc=
=26.7>19,该反应未达平衡状态,反应向逆反应进行;
故答案为:否;逆反应;
(3)增大压强平衡向气体体积减小的方向移动,由于a+b>c+d,故平衡向正反应移动;
升高温度,平衡向逆反应方向移动,说明正反应是放热反应,即a<0;
故答案为:正反应;<.
| c2(CO) |
| c(CO2) |
反应C(s)+H2O(g)?CO(g)+H2(g)的平衡常数为K1=
| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| c2(CO) |
| c(CO2) |
故答案为:
| c2(CO) |
| c(CO2) |
(2)该温度下SO2转化率为80%时,△c(SO2)=1mol?L-1×80%=0.8mol/L,则:
2SO2(g)+O2 (g)?2SO3(g),
开始(mol/L):1 1 0
变化(mol/L):0.8 0.4 0.8
SO2转化率为80%时(mol/L):0.2 0.6 0.8
所以浓度商Qc=
| 0.82 |
| 0.22×0.6 |
故答案为:否;逆反应;
(3)增大压强平衡向气体体积减小的方向移动,由于a+b>c+d,故平衡向正反应移动;
升高温度,平衡向逆反应方向移动,说明正反应是放热反应,即a<0;
故答案为:正反应;<.
点评:本题考查化学平衡常数及计算、化学平衡影响因素等,难度中等,平衡常数的有关计算是高考的热点,注意化学平衡常数的书写,利用平衡常数可以判断反应进行的程度,判断反应的热效应,判断反应进行的方向,计算转化率等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
苯环结构中,不存在单双键交替结构,可以作为证据的事实是( )
①苯不能使 KMnO4(H+)溶液褪色 ②苯分子中碳原子之间的距离均相等 ③苯能在一定条件下跟H2加成生成环己烷 ④经实验测得邻二甲苯仅一种结构 ⑤苯在FeBr3存在的条件下同液溴可以发生取代反应,但不因化学变化而使溴水褪色.
①苯不能使 KMnO4(H+)溶液褪色 ②苯分子中碳原子之间的距离均相等 ③苯能在一定条件下跟H2加成生成环己烷 ④经实验测得邻二甲苯仅一种结构 ⑤苯在FeBr3存在的条件下同液溴可以发生取代反应,但不因化学变化而使溴水褪色.
| A、②③④⑤ | B、①②④⑤ |
| C、①③④⑤ | D、①②③④ |
 已知反应:2CH3COCH3(l)
已知反应:2CH3COCH3(l)| 催化剂 |
| 加热 |
| A、b代表0℃下CH3COCH3的Y-t曲线 | ||
B、反应进行到20min末,用H3COCH3表示的速率之比
| ||
| C、升高温度可缩短反应达平衡的时间并能提高平衡转化率 | ||
D、从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
|
下列有关碱金属铷(Rb)的叙述中,正确的是( )
| A、铷与水反应的现象与钠相似 |
| B、硝酸铷易溶于水 |
| C、在钠、钾、铷三种单质中,铷的熔点最低 |
| D、氢氧化铷是弱碱 |
下列过程或现象与盐类水解无关的是( )
| A、纯碱溶液除油污 |
| B、加热氯化铁溶液颜色变深 |
| C、铁在潮湿的环境下生锈 |
| D、浓硫化钠溶液有臭味 |
 卢瑟福的α粒子轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了基础.如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )
卢瑟福的α粒子轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了基础.如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )| A、abcd | B、abc |
| C、bcd | D、ad |
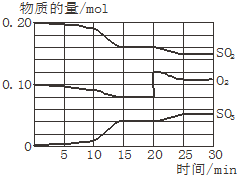 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题: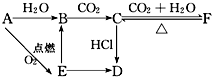 A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断: