题目内容
下列四支试管中,过氧化氢分解的化学反应速率最大的是
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| A | 室温(25℃) | 12% | 有 |
| B | 水浴加热(50℃) | 4% | 无 |
| C | 水浴加热( 50℃) | 12% | 有 |
| D | 室温(25℃) | 4% | 无 |
C
解析试题分析:使用合适的催化剂,改变反应历程,加快反应;升高温度,活化分子百分数增加,有效碰撞增多,加快反应;增大浓度,增加单位体积内的活化分子数,反应加快,显然只有C中温度高、浓度大、使用催化剂,则C中反应速率最快。
考点:化学反应速率的影响因素
故选C。
点评:本题考查了利用对比的方式进行实验探究的知识,培养了学生分析问题解决问题的能力,认识对化学反应速度影响的因素。

练习册系列答案
相关题目
I.下列四支试管中,过氧化氢分解的化学反应速率最大的是
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| a | 室温(25℃) | 12% | 有 |
| b | 水浴加热(50℃) | 4% | 无 |
| c | 水浴加热(50℃) | 12% | 有 |
| d | 室温(25℃) | 4% | 无 |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(2)写出实验③的化学反应方程式 。
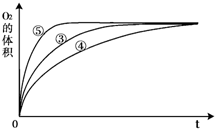
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。

分析上图能够得出的实验结论是 _________________________。
I.下列四支试管中,过氧化氢分解的化学反应速率最大的是
|
试管 |
温度 |
过氧化氢浓度 |
催化剂 |
|
a |
室温(25℃) |
12% |
有 |
|
b |
水浴加热(50℃) |
4% |
无 |
|
c |
水浴加热(50℃) |
12% |
有 |
|
d |
室温(25℃) |
4% |
无 |
II.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
|
实验编号 |
反应物 |
催化剂 |
|
① |
10mL2% H2O2溶液 |
无 |
|
② |
10mL5% H2O2溶液 |
无 |
|
③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
|
④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
|
⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是____________________________。
(2)写出实验③的化学反应方程式 。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。

分析上图能够得出的实验结论是 _________________________。
 O2↑+2H2O
O2↑+2H2O