题目内容
、在四个脱落标签的试剂瓶中,分别盛有盐酸、AgNO3溶液、BaCl2溶液、Na2CO3 溶液.为了鉴别各瓶中的试剂,将它们分别编号为 A、B、C、D,并两两混合反应,其实验现象为:
A+B产生无色气体,B+C产生白色沉淀,A+D产生白色沉淀,B+D无明显变化
A+B反应的离子方程式为 ,
B+C反应的离子方程式为 .
A+B产生无色气体,B+C产生白色沉淀,A+D产生白色沉淀,B+D无明显变化
A+B反应的离子方程式为
B+C反应的离子方程式为
考点:几组未知物的检验
专题:物质检验鉴别题
分析:根据物质的性质结合反应的现象判断,盐酸、BaCl2溶液、Na2CO3溶液中分别加入AgNO3溶液都产生沉淀;盐酸与Na2CO3溶液反应只产生气体;Na2CO3溶液与BaCl2溶液、AgNO3溶液反应都产生白色沉淀;盐酸与BaCl2溶液不反应,以此进行推断,结合物质的性质书写反应的有关离子方程式.
解答:
解:盐酸、BaCl2溶液、Na2CO3溶液中分别加入AgNO3溶液都产生沉淀;盐酸与Na2CO3溶液反应只产生气体;Na2CO3溶液与BaCl2溶液、AgNO3溶液反应都产生白色沉淀;盐酸与BaCl2溶液不反应,A+B→无色气体,则A、B应为盐酸与Na2CO3溶液中的物质,A+C→无明显现象,则A、C应为盐酸、BaCl2溶液中的物质,所以A为盐酸、B为Na2CO3溶液、C为BaCl2溶液,则D为AgNO3溶液.
A为盐酸、B为Na2CO3溶液,二者反应生成NaCl、CO2和H2O,反应的离子方程式为CO32-+2H+=CO2↑+H2O,
B为Na2CO3溶液、C为BaCl2溶液,二者反应生成BaCO3和NaCl,反应的离子方程式为Ba2++CO32-=BaCO3↓,
故答案为:CO32-+2H+=CO2↑+H2O;Ba2++CO32-=BaCO3↓.
A为盐酸、B为Na2CO3溶液,二者反应生成NaCl、CO2和H2O,反应的离子方程式为CO32-+2H+=CO2↑+H2O,
B为Na2CO3溶液、C为BaCl2溶液,二者反应生成BaCO3和NaCl,反应的离子方程式为Ba2++CO32-=BaCO3↓,
故答案为:CO32-+2H+=CO2↑+H2O;Ba2++CO32-=BaCO3↓.
点评:本题考查物质的推断,题目难度中等,本题注意把握物质的性质,根据反应的显现进行推断.

练习册系列答案
相关题目
下列说法中,不正确的是( )
| A、现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比6:3:2 |
| B、在标准状况下,11.2 L某气体的质量为22 g,则该气体的摩尔质量是44g/mol |
| C、1mol氯化钙溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1mol/L |
| D、2.4 g金属镁变为镁离子时失去2×6.02×1022个电子 |
在一定条件下,某化合物Χ受热分解:2Χ=A↑+2B↑+4C↑.在相同条件下测得反应后生成的混合气体对H2的相对密度为11.43,Χ的相对分子质量是( )
| A、11.43 |
| B、22.85 |
| C、80.01 |
| D、160.02 |
如图是联合制碱法的工业流程示意图(操作已略去).下列分析正确的是( )
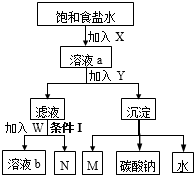

| A、X和M是同种物质 |
| B、W是氯化钠固体和X |
| C、溶液b和N能循环利用 |
| D、条件Ⅰ是加热 |