题目内容
1.下列离子方程式书写正确的是( )| A. | 钠和水作用:Na+2H2O═Na++H2↑+2OH- | |
| B. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | |
| C. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 氯气溶于水:Cl2+H2O═H++Cl-+HClO |
分析 A.电子、电荷不守恒;
B.漏写生成水的离子反应;
C.碳酸氢根离子不能拆分;
D.反应生成盐酸和HClO.
解答 解:A.钠和水作用的离子反应为2Na+2H2O═2Na++H2↑+2OH-,故A错误;
B.稀硫酸与氢氧化钡溶液混合的离子反应为2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O,故B错误;
C.NaHCO3溶液中加入盐酸的离子反应为HCO3-+H+═H2O+CO2↑,故C错误;
D.氯气溶于水的离子反应为Cl2+H2O═H++Cl-+HClO,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
11.下列解释事实的化学方程式或离子方程式不正确的是( )
| A. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| B. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 | |
| C. | 在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2 | |
| D. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 |
12.各取1mol 下列物质与溴水充分反应,消耗Br2的物质的量按①②顺序排列正确的是( )
①漆酚: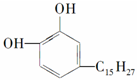 ②白藜芦醇
②白藜芦醇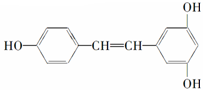
①漆酚:
 ②白藜芦醇
②白藜芦醇
| A. | 2mol、6mol | B. | 5mol、6mol | C. | 4mol、5mol | D. | 3mol、6mol |
9.以下物质:(1)甲烷;(2)苯;(3)聚乙烯;(4)2-丁炔;(5)环己烷;(6)邻二甲苯;(7)苯乙烯.既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )
| A. | (3)(4)(5) | B. | (4)(5)(7) | C. | (4)(7) | D. | (3)(4)(5)(7) |
16.短周期元素X、Y的原子序数相差2,下列叙述正确的是( )
| A. | X与Y不可能位于同一周期 | |
| B. | X与Y不可能形成原子个数比为1:1型离子化合物 | |
| C. | X离子与Y离子的电子层结构可以相同 | |
| D. | X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构 |
6.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA | |
| D. | 常温常压下,46 g的NO2与N2O4混合物含有的原子数为3 NA |
13.2014年7月31日中国经济网:河北省开展“环保亮剑”专项整治行动,强化“三废”治理.某工厂废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等成分,回收废渣中的金属元素的工艺流程如图所示:
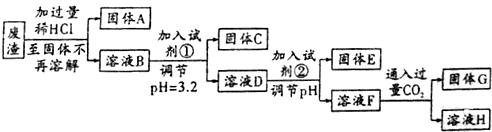
己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
(1)试剂①为C,试剂②为B;
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).

己知:常温下,饱和氨水的pH约为11,金属离子沉淀所需pH数据如表所示:
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
A.AgNO3 B.NaOH C.NH3•H2O D.H2SO4
(2)固体C的化学式是Fe(OH)3,溶液F中金属元素的存在形式为AlO2-、Na+;
(3)写出固体A与试剂②反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O;F中通入过量CO2所发生的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)加入试剂②,实现溶液D到溶液F的转化,则调节溶液的pH为D.
A.6 B.10 C.12 D.13
(5)25℃时,按(4)调节pH后测得溶液F中c(Mg2+)=5.6×10-10mol/L,则氢氧化镁的Ksp=5.6×10-12;
(6)最后一步反应中涉及到两种盐,其中酸式盐的溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
10.下列关于SiO2和金刚石的叙述正确的是( )
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 12g金刚石含4molC-C键 | |
| D. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
11.已知原子序数为a的ⅡA族元素X和原子序数为b的ⅢA族元素Y位于元素周期表中同一周期,下列的量值关系不正确的是( )
| A. | b=a+34 | B. | a=b-11 | C. | b=a+25 | D. | a=b-1 |