题目内容
2.在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.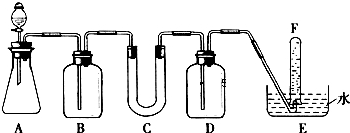
(1)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | 石棉绒与过氧化钠 | 与CO2反应,产生O2 |
| D | 吸收未反应的CO2气体 |
A.5.8 B.11.6 C.23.2 D.46.4
(3)为了达到实验目的,不需要(填“需要”或“不需要”)在B装置之后增加一个吸收水蒸气的装置;若你认为需要增加一个吸收水蒸气的装置,应选用此空不填做吸水剂;若你认为不需要,请说明理由:因为水蒸气也能与过氧化钠反应生成氧气,不影响实验目的.
(4)试管F中收集满气体后,下一步实验操作是:把F中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.
分析 (1)由实验装置可知,本实验首先由CaCO3和盐酸反应生成CO2,产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反应,产生O2,用排水法收集O2,最后取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气;
(2)向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=$\frac{m}{M}$计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),进而计算原混合气体的平均相对分子质量;
(3)因为过氧化钠除了与二氧化碳反应生成氧气外,还与水蒸气也反应生成氧气,所以在B装置之后不需要增加一个吸收水蒸气的装置;
(4)为防止倒吸需要先把导气管从水槽中拿出,用姆指堵住试管口,取出试管,依据氧气的检验方法能使带火星的木条复燃检验氧气的存在.
解答 解:(1)产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反应,产生O2;由于生成的氧气中混有二氧化碳气体,应用NaOH溶液洗气,吸收未反应的CO2气体,用排水法收集O2,
故答案为:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 除去CO2气体中混入的HCl | |
| C | 过氧化钠 | |
| D | NaOH溶液 |
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知n(混合气体)=2n(O2)=2×0.25mol=0.5mol,
所以原混合气体的平均摩尔质量为:$\frac{11.6g}{0.5mol}$=23.2g/mol,故混合气体的平均相对分子质量为23.2,
故答案为:C;
(3)因为过氧化钠除了与二氧化碳反应生成氧气外,还与水蒸气也反应生成氧气,所以在B装置之后不需要增加一个吸收水蒸气的装置,
故答案为:不需要;因为水蒸气也能与过氧化钠反应生成氧气,不影响实验目的;
(4)本实验的目的为证明过氧化钠可作供氧剂,收集气体后要验证是否为氧气,为防止倒吸,应先把F中的导管移出水面,然后关闭分液漏斗活塞,用带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气,
故答案为:把F中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.
点评 本题考查了性质试验方案的设计与评价,题目难度中等,明确过氧化钠与二氧化碳以及和水反应的原理为解答关键,注意掌握性质试验方案的设计与评价原则,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
2.一种新型燃料电池,用两根金属作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应为X极:CH4+10OH--8e-═CO32-+7H2O;Y极:4H2O+2O2+8e-═8OH-.下列关于此燃料电池的说法中,错误的是( )
| A. | X为负极,Y为正极 | |
| B. | 工作一段时间后,KOH的物质的量减少 | |
| C. | 在标准状况下,通入 5.6 L O2完全反应后,有1 mol电子发生转移 | |
| D. | 该电池工作时,X极附近溶液的碱性增强 |
3.下列有关说法正确的是( )
| A. | 用过氧化钠除去CO气体中混有的少量CO2 | |
| B. | 用酸性KMnO4溶液可以检验CH2=CHCH2OH中是否含有碳碳双键 | |
| C. | 用乙醚萃取青蒿中青蒿素时使用的主要仪器是分液漏斗 | |
| D. | 在滴定实验中,量取待测液的滴定管未用待测液润洗,会使测定结果偏高 |
20.向三只盛有1.5mL0.02mol/LCa(OH)2溶液的试管中,分别加入相同浓度的磷酸,当分别生成磷酸钙、磷酸氢钙和磷酸二氢钙时,所消耗磷酸溶液的体积比是( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 2:3:6 | D. | 6:3:2 |
7.下列说法中正确的是( )
| A. | 含有羟基的化合物一定属于醇类化合物 | |
| B. | 醇类化合物的官能团是跟链烃基相连的 | |
| C. | 96%的乙醇跟过量的Na混合,加热蒸馏可制得无水乙醇 | |
| D. | 白酒瓶标鉴上的“28°”是指含水28%(体积分数) |
11.用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 46g NO2和N2O4以任意比混合,所得混合气体中氧原子数为NA | |
| B. | 标准状况下,含2NA个单键的甲醛分子所占的体积约为22.4 L | |
| C. | 1mol Fe 与一定量的硝酸反应,转移的电子数为0.2NA~0.3NA | |
| D. | 1mol N2和3mol H2混合,在密闭容器中充分反应后,容器内的N-H键数可能等于5NA |
12.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA | |
| B. | 将lmol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA | |
| C. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA | |
| D. | 将CO2通过Na2O2使其增重a克时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ |

 ,请回答下列问题:
,请回答下列问题: .
. (写结构简式,一种即可).
(写结构简式,一种即可). 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选). .
.