题目内容
9.某化学反应2A?B+D在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.60 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20分钟时间内平均速率为0.013mol/(L•min).
(2)设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1(填>、=、<),且c3>1.0mol/L(填>、=、<)
(3)比较实验4和实验1,可推测该反应是吸热反应(选填吸热、放热).理由是由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动.
分析 (1)根据v=$\frac{△c}{△t}$解题;
(2)以10至20min为例求出实验1和实验3的反应速率进行比较;
(3)根据化学平衡移动原理分析,加热平衡向吸热反应方向移动.
解答 解:(1)在实验1中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.80mol/L-0.67mol/L}{10min}$=0.013mol•(L•min)-1,
故答案为:0.013;
(2)在实验1中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.80mol/L-0.67mol/L}{10min}$=0.013mol•(L•min)-1,
在实验3中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.92mol/L-0.75mol/L}{10min}$=0.015mol•(L•min)-1,故v3>v1,实验1的其实浓度为1.0mol/L,由平衡时浓度可知在实验3的起始浓度大于1.0mol/L,
故答案为:>;>;
(3)比较实验4和实验1可知平衡时实验4反应物A的浓度小,由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动;
故答案为:吸热;由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动.
点评 本题考查反应速率的表示方法,化学平衡移动的判断,掌握反应速率的计算方法是解题的关键,题目难度中等.

练习册系列答案
相关题目
17.某黑色粉末有两种物质组成,为鉴定其成分进行如下实验:①取少量样品加入足量冷的稀硫酸,有气泡产生,固体部分溶解;②另取少量样品加入足量浓盐酸并加热,有气泡产生,固体全部溶解.( )
| A. | Fe3O4、CuO | B. | C、CuO | C. | Fe、MnO2 | D. | Si、FeS |
20.在一定温度、压强下,2mol X2(气)和6mol Y2(气)化合生成4mol的气体化合物,则该气体化合物的化学式为( )
| A. | XY3 | B. | XY | C. | X3Y | D. | X2Y3 |
4.一定条件下,a L密闭容器中放入1molN2和3molH2发生N2+3H2?2NH3的反应,下列选项中能说明反应已达到平衡状态的是( )
| A. | c(N2):c(H2):c(NH3)=1:3:2 | |
| B. | 2v(H2)=3v(NH3) | |
| C. | 单位时间内1个N≡N键断裂的同时,有6个N-H键断裂 | |
| D. | 单位时间消耗0.1molN2的同时,生成0.2molNH3 |
14.a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如表所示
由上述现象可推知a、b、c、d依次是( )
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
| A. | HCl、BaCl2、AgNO3、Na2CO3 | B. | AgNO3、HCl、BaCl2、Na2CO3 | ||
| C. | BaCl2、Na2CO3、AgNO3、HCl | D. | AgNO3、HCl、Na2CO3、BaCl2 |
18.表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
(1)第3周期中金属性最强的元素是钙(填元素名称);
(2)S原子结构示意图为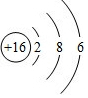 ;
;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第3周期中气态氢化物最稳定的是HCl;
(6)Si是带来人类文明的重要元素之一,其氧化物化学式是SiO2,常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(7)N元素形成的一种氢化物的化学式是NH3,俗话说“雷雨发庄稼”,请写出二氧化氮溶 于水的反应3NO2+H2O═2HNO3+NO.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
(2)S原子结构示意图为
 ;
;(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第3周期中气态氢化物最稳定的是HCl;
(6)Si是带来人类文明的重要元素之一,其氧化物化学式是SiO2,常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(7)N元素形成的一种氢化物的化学式是NH3,俗话说“雷雨发庄稼”,请写出二氧化氮溶 于水的反应3NO2+H2O═2HNO3+NO.
 I.(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1 时引起平衡移动的条件可能是增大压强.
I.(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1 时引起平衡移动的条件可能是增大压强.