题目内容
2. 以NaCl等为原料制备KClO4的过程如下:
以NaCl等为原料制备KClO4的过程如下:①在无隔膜、微酸性条件下,发生反应:NaCl+H2O-NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3.
③一定条件下反应:4KClO3$\frac{\underline{\;668K\;}}{\;}$3KClO4+KCl,将产物分离得到KClO4.
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为1.344L(标准状况).
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是低温时,KClO3溶解度小,从溶液中结晶析出.
(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积为21.00mL.滴定达到终点时,产生砖红色Ag2CrO4沉淀.
①已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=1.8×10-6mol/L.
②计算KClO4样品的纯度(请写出计算过程.)
分析 (1)先配平化学方程式,结合化学方程式定量关系计算得到;
(2)在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3.利用的是溶解度不同析出晶体;
(3)①依据Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,计算得到银离子浓度,结合Ksp(AgCl)=1.8×10-10,计算得到氯离子浓度;
②准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积为21.00mL.
n(AgNO3)=0.2000 mol•L-1×0.021L=0.0042 mol,
n(KCl)总=n(AgNO3)=0.0042 mol
n(KClO4)+n(KCl)=0.0042 mol,
n(KClO4)×138.5 g•mol-1+n(KCl)×74.5 g•mol-1=0.56890g,
n(KClO4)=0.0040 mol,
m(KClO4)=0.004 mol×138.5 g•mol-1=0.554g,250ml溶液中m(KClO4)=5.54g,
纯度=$\frac{KCl{O}_{4}质量}{样品质量}$×100%.
解答 解:(1)电解时,产生质量为2.13g NaClO3,物质的量=$\frac{2.13g}{106.5g/mol}$=0.02mol
NaCl+3H2O=NaClO3+3H2↑,
1 3
0.02mol 0.06mol
同时得到H2的物质的量为0.06mol,体积=0.06mol×22.4L/mol=1.344L,
故答案为:1.344;
(2)在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3的原因是低温时,KClO3溶解度小,从溶液中结晶析出,
故答案为:低温时,KClO3溶解度小,从溶液中结晶析出;
(3)①若c(CrO42-)=1.1×10-4mol/L,Ksp(Ag2CrO4)=c2(Ag+)c(CrO4 2-)=1.1×10-12,c(Ag+)=10-4mol/L,
Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,c(Cl-)=1.8×10-6 mool/L,
故答案为:1.8×10-6;
②准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积为21.00mL.
n(AgNO3)=0.2000 mol•L-1×0.021L=0.0042 mol,
n(KCl)总=n(AgNO3)=0.0042 mol
n(KClO4)+n(KCl)=0.0042 mol,
n(KClO4)×138.5 g•mol-1+n(KCl)×74.5 g•mol-1=0.56890g,
n(KClO4)=0.0040 mol,
m(KClO4)=0.004 mol×138.5 g•mol-1=0.554g,250ml溶液中m(KClO4)=5.54g
KClO4样品的纯度=$\frac{5,54g}{5.689g}$×100%=97.3%,
答:n(AgNO3)=0.2000 mol•L-1×0.021L=0.0042 mol,
n(KCl)总=n(AgNO3)=0.0042 mol
n(KClO4)+n(KCl)=0.0042 mol,
n(KClO4)×138.5 g•mol-1+n(KCl)×74.5 g•mol-1=0.56890g,
n(KClO4)=0.0040 mol,
m(KClO4)=0.004 mol×138.5 g•mol-1=0.554g,
250ml溶液中m(KClO4)=5.54g
KClO4样品的纯度=$\frac{5,54g}{5.689g}$×100%=97.3%.
点评 本题考查了物质的组成和含量的测定,主要是滴定实验的过程和计算,掌握基础是解题关键,题目难度中等.

| A. | 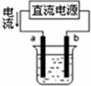 用如图装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 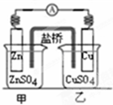 如图装置的盐桥中KCl的Cl-移向乙烧杯 | |
| C. |  如图装置中钢闸门应与外接电源的负极相连获得保护 | |
| D. | 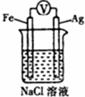 装置中滴入2滴黄色K3[Fe(CN)6]溶液,溶液中可能出现蓝色沉淀 |
| A. | 钾的相对原子质量较大 | |
| B. | 钾的密度比钠小 | |
| C. | 钾的原子半径大,失去电子的能力强 | |
| D. | 钾比钠与水反应更剧烈 |
| A. | KCl、Na2SO4 | B. | KCl、Na2SO4、NaCl | ||
| C. | NaCl、Na2SO4、K2SO4 | D. | KCl、K2SO4、Na2SO4 |
 食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示.下列说法不正确的是 ( )
食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益,其分子结构如图所示.下列说法不正确的是 ( )| A. | 油酸的分子式为C18H34O2 | |
| B. | 油酸可与氢氧化钠溶液发生中和反应 | |
| C. | 1 mol油酸可与2 mol H2发生加成反应 | |
| D. | 1 mol甘油可与3 mol油酸发生酯化反应 |
| A. | 稀硫酸 | B. | 浓盐酸 | C. | 浓硫酸 | D. | 浓氢氧化钠溶液 |
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下: